 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторна робота 1
|
|
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ. ОСНОВНІ ПОНЯТТЯ АТОМНО-МОЛЕКУЛЯРНОГО ВЧЕННЯ. СТЕХІОМЕТРИЧНІ ЗАКОНИ ХІМІЇ
Мета роботи: навчитися експериментально визначати молярні маси еквівалентів металів.
Теоретичні відомості
Молярні маси еквівалентів металів визначають об’ємним методом за кількістю газу, масу якого розраховують за рівнянням Менделєєва-Клапейрона. Далі молярну масу еквівалентів металу розраховують за законом еквівалентів.
Завдання для домашньої підготовки
Речовина і поле як форми існування матерії. Предмет та задачі хімії. Місце хімії в системі наук.
Основні поняття хімії: атом, елемент, прості та складні речовини, алотропія. Молекула. Атомна і молекулярна маса. Моль, молярна маса.
Закон еквівалентів. Еквівалент, еквівалентна маса елемента. Молярна маса еквівалентів. Поняття про еквіваленти складних речовин.
Закони збереження маси речовин, сталості складу. Межі їх застосування, пояснення з позицій атомно-молекулярного вчення. Закон Авогадро та його наслідки. Молярний об’єм газу. Поняття про відносну густину газу. Способи визначення молекулярних мас газоподібних речовин.
Контрольні запитання і задачі
1. Що таке атом, елемент, проста речовина? У чому відмінності понять елемент і проста речовина?
2. Що таке еквівалент, еквівалентна маса? Чи може еквівалент бути ідентичним атому, молекулі речовини, в яких випадках?
3. Сформулюйте закон еквівалентів, наведіть його математичний вираз та поясніть його з позицій атомно-молекулярного вчення.
4. Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів:
а) сульфуру в сполуках 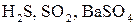 ;
;
б) фосфору в сполуках 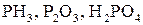 .
.
5. Чому дорівнюють еквівалент, еквівалентна маса та молярна маса еквівалентів складних сполук:
а) сульфатної кислоти 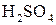 та ортофосфатної кислоти
та ортофосфатної кислоти  ;
;
б) гідроксидів феруму(II) 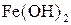 i феруму(III)
i феруму(III) 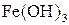 ;
;
в) нітрату магнію 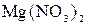 та ортофосфату магнію
та ортофосфату магнію 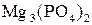 ?
?
6. Метал (М) взаємодіє з сіркою (S). Валентність сульфуру у продукті реакції дорівнює 2. Визначте еквівалентну масу металу, якщо:
а) m(M) = 3 г, m(S) = 1,64 г;
б) m(M) = 1,74 г, m(S) = 1 г;
в) m(M) = 1 г, m(S) = 1,78 г.
7. Наважка металу (m(M)) витісняє з кислоти 0,56 л водню (н.у.). Розрахуйте еквівалентну масу металу. Маса металу в г подана далі:
а) 2,81;
б) 0,347.
8. Визначте об’єм кисню (н.у.), що витрачається при згорянні 8 г металу, еквівалентна маса якого дорівнює 20.
9. При спалюванні 3 г двовалентного металу утворилося 4,2 г його оксиду. Визначте, користуючись законом еквівалентів, атомну масу металу.
10. Сформулюйте закон збереження маси речовин, поясніть його з позицій атомно-молекулярного вчення.
11. Сформулюйте закон сталості складу, поясніть його з позицій атомно-молекулярного вчення.
12. Наведіть формулювання закону Авогадро, вкажіть межі його застосування, поясніть з позицій молекулярно-кінетичної теорії.
13. Сформулюйте наслідки закону Авогадро.
14. Що таке густина та відносна густина газів? Як їx можна використати для визначення молекулярних мас газів?
15. Поясніть, де міститься більше атомів в: 1 г заліза чи в 1 г сірки? Наведіть необхідні розрахунки.
16. Яка кількість речовини (моль) та скільки молекул міститься в 7 г азоту? Який об’єм займають 7 г азоту за н.у.?
17. Густина газу за воднем становить 29. 3найдіть його молярну масу, відносну густину за повітрям та масу однієї молекули.
18 0бчисліть молярну масу газу, 6 г якого займає об’єм 7 л за температурі 477 0C і тиску 83,1 кПа (R = 8,31 Дж/(моль К)).
19. За деякої температури густина пари сірки за повітрям складає 6,62, а фосфору - 4,28. Скільки атомів сульфуру та фосфору входить до складу молекул за цих умов?
20. Густина за повітрям газоподібної сполуки силіцію з гідрогеном доpiвнює 4,22. 3найдіть її формулу, якщо ця сполука мicтить 91,77 % силіцію.
21*. В результаті розкладання 21 г карбонату двовалентного металу виділилось 5,6 л оксиду карбону(ІV) (за н.у.). Встановити формулу солі.
Дата публикования: 2014-11-04; Прочитано: 1673 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
