 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вправа 4
|
|
1. Чому дорівнює об'єм одного моля будь-якого газу за нормальних умов?
2. Яка кількість речовини міститься у газі, якщо при тиску 200 кПа і температурі 240 К його об’єм дорівнює 40 л?
3. Який тиск стиснутого повітря, що знаходиться в балоні місткістю 20 л при 12˚ С, якщо маса цього повітря 2 кг?
4. Газ при тиску 0,2 МПа і температурі 15˚ С має об’єм 5 л. Чому дорівнює об’єм газу цієї маси за нормальних умов?
5. У балоні знаходиться газ при температурі 15˚ С. У скільки разів зменшиться тиск газу, якщо 40% його вийде з балона, а температура при цьому зменшиться на 8˚ С?
§12. Ізопроцеси
· Ізопроцеси
· Закон Бойля-Маріотта. Графіки ізотермічного процесу
· Закон Гей-Люссака. Графіки ізобарного процесу
· Закон Шарля. Графіки ізохорного процесу
Ізопроцеси. За допомогою рівняння стану ідеального газу можна досліджувати процеси, в яких маса газу і один із трьох параметрів залишаються незмінними.
Процеси, які відбуваються за незмінного значення одного з параметрів ідеального газу сталої маси m і певного сорту μ називають ізопроцесами (від грец. ізос – рівний, однаковий).
Оскільки жоден із параметрів газу не може бути суворо фіксованим, то ізопроцес – це ідеалізована модель стану ідеального газу.
Закон Бойля – Маріотта. Графіки ізотермічного процесу. Розглянемо процес, що відбувається за сталої температури. Процес зміни стану термодинамічної системи за сталої температури називають ізотермічним (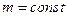 ,
,  ,
, 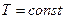 ).
).
Якщо до ізотермічного процесу застосувати рівняння стану у вигляді 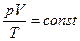 , то, з урахуванням сталості температури, воно набуде вигляду:
, то, з урахуванням сталості температури, воно набуде вигляду: 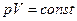 ,
,
або  чи
чи 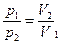 при T = const.
при T = const.
  Р. Бойль Е. Маріотт
Р. Бойль Е. Маріотт
| Рівняння 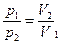 до створення молекулярно-кінетичної теорії було здобуто з експериментів англійським фізиком Р. Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.). до створення молекулярно-кінетичної теорії було здобуто з експериментів англійським фізиком Р. Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.).
|
Закон Бойля – Маріотта можна сформулювати так: для ідеального газу деякої маси (сталої кількості речовини) за сталої температури тиск газу змінюється обернено пропорційно до об’єму.
Цей закон, як і інші газові закони, є результатом із рівняння стану газу і справедливий для будь-яких газів, які можна вважати ідеальними, а також для їх сумішей (наприклад, для повітря).
Часто закон Бойля – Маріотта записують так: р = 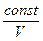 . Графічно залежність тиску газу сталої маси від об’єму при умові
. Графічно залежність тиску газу сталої маси від об’єму при умові 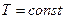 можна зобразити у вигляді гіперболи (порівняйте з у =
можна зобразити у вигляді гіперболи (порівняйте з у = 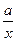 ), яка для цього процесу називається ізотермою (мал. 18, а).
), яка для цього процесу називається ізотермою (мал. 18, а).
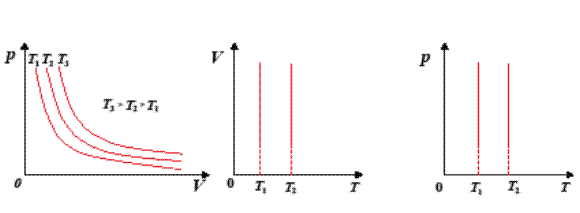
Мал. 18. Ізотерми: а) в координатах рV, б) в координатах VТ, в) в координатах рТ
Різним температурам відповідають різні ізотерми – чим вища температура, тим вище на координатній площині рV знаходиться гіпербола (Т 2 > Т 1). Це корисно знати для розв’язування графічних задач.
На координатних площинах рТ і VT ізотерми зображуються прямими, перпендикулярними до осі температур: у координатах 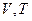 (мал. 18, б), у координатах
(мал. 18, б), у координатах  (мал. 18, в).
(мал. 18, в).
Ізотермічним можна вважати процес стиснення повітря компресором або розширення під поршнем насоса газу в результаті відкачування його з посудини.
Закон Гей-Люссака. Графіки ізобарного процесу. Процес зміни стану термодинамічної системи за сталого тиску називають ізобарним (від грец. барос – вага) ( ,
,  ,
, 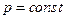 ).
).
Цей закон установив експериментально у 1802 р. французький учений Гей-Люссак.
 Жозеф Луї Гей-Люссак
Жозеф Луї Гей-Люссак
|
Відповідно до рівняння 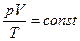 для ідеального газу певної маси з незмінним тиском відношення об’єму до температури залишається сталим:
для ідеального газу певної маси з незмінним тиском відношення об’єму до температури залишається сталим: 
або 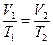 при p = const.
при p = const.
Відповідно до  об’єм газу лінійно залежить від температури за сталого тиску:
об’єм газу лінійно залежить від температури за сталого тиску: 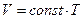 (порівняйте з
(порівняйте з  ).
).
Експериментально перевірити цей закон можна за допомогою пристрою, що є в багатьох кабінетах фізики – скляної колби із зігнутою трубкою (мал. 19).
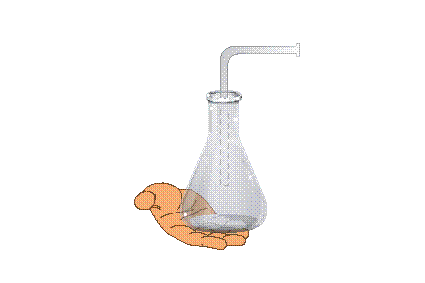
Мал. 19. Пристрій для дослідження ізобарного процесу
У горизонтальній частині трубки є крапля рідини, яка відокремлює газ у колбі від атмосферного повітря. Якщо підігріти колбу (можна й руками), то крапля рідини зміститься вправо, тобто об’єм газу, який знаходиться в колбі, збільшиться, а тиск залишиться рівним атмосферному.
Графік залежності об’єму від температури за сталого тиску є прямою лінією, яку називають ізобарою.
На мал. 20, а зображено дві ізобари в координатах 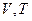 за різних значень тиску
за різних значень тиску  і
і  , причому
, причому 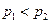 .
.
На мал. 20, б, в наведено графіки ізобарного процесу в координатах  та
та 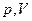 .
.
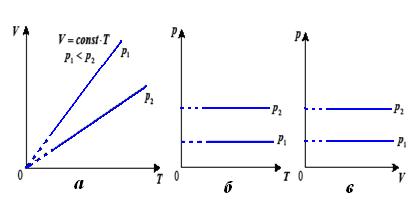
Мал. 20. Ізобари
Закон Шарля. Графіки ізохорного процесу. Процес зміни стану термодинамічної системи за сталого об’єму називають ізохорним (від грец. хорема – місткість).
Якщо (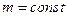 ,
,  ,
,  ) то з рівняння стану
) то з рівняння стану 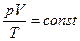 випливає, що для ідеального газу певної маси з незмінним об’ємом відношення тиску газу до температури залишається сталим:
випливає, що для ідеального газу певної маси з незмінним об’ємом відношення тиску газу до температури залишається сталим: 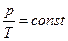 або
або 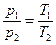 при V = const.
при V = const.
У 1787 р. цей газовий закон експериментально встановив французький фізик Ж. Шарль, тому його називають законом Шарля.
| Шарль |
Відповідно до 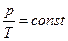 тиск газу лінійно залежить від температури за сталого об’єму:
тиск газу лінійно залежить від температури за сталого об’єму:  (порівняйте
(порівняйте  ).
).
Графіком залежності тиску від температури за сталого об’єму є пряма лінія, яку називають ізохорою. На мал. 21, а в координатах  зображено дві ізохори за різних значень об’єму
зображено дві ізохори за різних значень об’єму 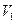 і
і 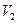 , причому
, причому 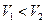 .
.
На мал. 21, б, в наведено графіки процесу в координатах 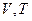 і
і 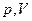 .
.
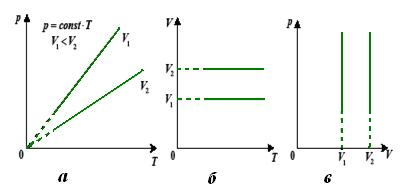
Мал. 21. Ізохори
Дайте відповіді на запитання
1. Який процес називають ізотермічним? Яким законом описується цей процес? Зобразіть і поясніть графіки ізотермічного процесу.
2. Який процес називають ізобарним? Яким законом описують ізобарний процес? Зобразіть і поясніть графіки ізобарного процесу
3. Який процес називають ізохорним? Як формулюють і записують цей закон? Зобразіть і поясніть графіки ізохорного процесу
Дата публикования: 2014-10-25; Прочитано: 2867 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
