 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Молекулярно-кінетичний зміст температури
|
|
· Температура і середня кінетична енергія поступального руху молекул
· Стала Больцмана
· Абсолютна температура
Температура і середня кінетична енергія поступального руху молекул газу. У стані теплової рівноваги макропараметри (тиск, об’єм, температура тощо) не змінюються як завгодно довго. Це означає, що в тілах не відбуваються хімічні реакції, агрегатні перетворення тощо. Однак це не означає, що всередині системи в стані теплової рівноваги не рухаються атоми й молекули: мікропроцеси в тілах не припиняються, оскільки ні на мить не припиняється тепловий рух молекул чи атомів. Положення і швидкості руху молекул у стані теплової рівноваги безперервно змінюються, а макропараметри – сталі, бо вони визначаються поводженням не окремих молекул, а їх усередненим результатом.
Якщо два тіла з різними температурами дотикаються, то їх молекули внаслідок хаотичного руху стикаються і відбувається передача енергії, яка триває доти, поки зрівняються середні кінетичні енергії молекул. У цей час і настає теплова рівновага.
Можна висловити припущення, що середня кінетична енергія молекул і температура однаково характеризують процес встановлення теплової рівноваги, тільки перша – мікроскопічно, а друга – макроскопічно.
Експериментально встановити зв'язок середньої кінетичної енергії молекул з температурою дуже важко, бо середню кінетичну енергію молекули не можна виміряти безпосередньо. Тому треба з’ясувати зв'язок середньої кінетичної енергії з величинами, які можна виміряти. Зробимо це на прикладі ідеального газу.
Звернемося до такого досліду. Візьмемо кілька посудин, заповнених різними газами, наприклад воднем, гелієм і киснем. Посудини мають певні об’єми і сполучені з манометрами. Це дає змогу виміряти тиск у кожній посудині. Маси газів відомі і тим самим відома кількість молекул у кожній посудині.
Приведемо гази у стан теплової рівноваги. Для цього вмістимо посудини у лід, що тане, і почекаємо, поки встановиться рівновага і тиск газів перестане змінюватись (мал. 17). Після цього можна стверджувати, що всі гази мають однакову температуру 0 °С. Тиск газів, їхні об’єми і кількості молекул будуть різними.

Мал. 17. Установка до досліду
За основним рівнянням МКТ тиск ідеального газу: 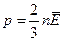 . Враховуючи, що
. Враховуючи, що 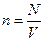 можна записати:
можна записати: 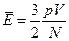 .
.
Отже середню кінетичну енергію молекул можна визначити, якщо виміряти тиск і об’єм газу та обчислити кількість молекул, знаючи масу газу, сталу Авогадро та молярну масу газу: 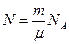 .
.
Виходячи з нашого припущення, якщо середня кінетична енергія (як і температура) однакова для всіх газів у стані теплової рівноваги, то і величина 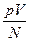 має бути однакова для всіх газів.
має бути однакова для всіх газів.
Проведені вимірювання підтвердили припущення: 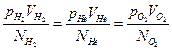 .
.
Звертаємо вашу увагу на той факт, що для тисків у тисячі атмосфер, коли густина газів стає досить значною, відношення 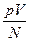 перестає бути точно визначеним, не залежним від об’ємів, що їх займають гази. Воно справджується для досить розріджених газів, які можна вважати ідеальними.
перестає бути точно визначеним, не залежним від об’ємів, що їх займають гази. Воно справджується для досить розріджених газів, які можна вважати ідеальними.
Якщо всі посудини з газами поставити у киплячу воду (100 °С) при нормальному атмосферному тискові, то 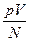 як і раніше, буде одним і тим самим для всіх газів, але збільшиться. Завдяки цьому можна стверджувати, що величина
як і раніше, буде одним і тим самим для всіх газів, але збільшиться. Завдяки цьому можна стверджувати, що величина 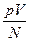 зростає з підвищення температури, більше того, ні від чого, крім температури, не залежить.
зростає з підвищення температури, більше того, ні від чого, крім температури, не залежить.
Цей дослідний факт дає змогу розглядати 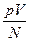 як величину температури, що вимірюється в енергетичних одиницях – джоулях. Проте, по-перше, це незручні для практичного застосування одиниці. Так, температурі 100 °С відповідала б дуже мала величина – порядку 10-21 Дж. А по-друге, і це головне, вже давно температуру вимірюють у градусах. Тому вважатимемо величину
як величину температури, що вимірюється в енергетичних одиницях – джоулях. Проте, по-перше, це незручні для практичного застосування одиниці. Так, температурі 100 °С відповідала б дуже мала величина – порядку 10-21 Дж. А по-друге, і це головне, вже давно температуру вимірюють у градусах. Тому вважатимемо величину 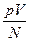 прямо пропорційною температурі Т, яку вимірюють у градусах (за шкалою Кельвіна):
прямо пропорційною температурі Т, яку вимірюють у градусах (за шкалою Кельвіна): 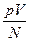 ~ Т або переходячи до знаку рівності:
~ Т або переходячи до знаку рівності:  .
.
Перепишемо формулу 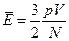 у вигляді
у вигляді  і прирівняємо її праву частину до правої частини формули
і прирівняємо її праву частину до правої частини формули  . Отримуємо
. Отримуємо 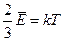 .
.
Звідки  - середня кінетична енергія хаотичного руху молекул газу пропорційна абсолютній температурі.
- середня кінетична енергія хаотичного руху молекул газу пропорційна абсолютній температурі.
Чим вища температура, тим швидше рухаються молекули. Отже, припущення про зв'язок температури і середньої кінетичної енергії руху молекул підтвердилось.
Стала Больцмана. Дане співвідношення отримав австрійський фізик Больцман. Він показав, що середня кінетична енергія поступального руху молекул газу лінійно залежить від температури.
 Людвиг Больцман
Людвиг Больцман
|
Коефіцієнт пропорційності, що входить до формули, називається сталою Больцмана, його значення: k = 1,38·10-23 Дж/К.
Для вимірювання температури можна використати довільні одиниці енергії. Проте історично склалося так, що для вимірювання температури було запропоновано спеціальні одиниці – градуси. Причина цього в тому, що вимірювати температуру навчилися раніше, ніж було з’ясовано її фізичний зміст. Саме стала Больцмана є тим коефіцієнтом, який переводить одиниці енергії в градуси.
Стала Больцмана – це фундаментальна фізична стала, яка пов’язує температуру в енергетичних одиницях з температурою у кельвінах. Чисельно дорівнює зміні кінетичної енергії однієї молекули ідеального газу зі зміною температури газу на 1 К.
Абсолютна температура. Абсолютна температура (або просто температура) – це макроскопічний параметр, який характеризує внутрішній тепловий стан тіла і визначається рухом величезної кількості його структурних елементів. У цьому розумінні температура є статистичною величиною, і тому поняття температури має сенс лише для величезної кількості молекул. Не можна говорити про температуру однієї або кількох (небагатьох) молекул, про «гарячі» або «холодні» молекули. Поняття температури втрачає сенс, наприклад, щодо газу в космічному просторі, де концентрація молекул настільки незначна, що вони не утворюють газу в звичайному розумінні цього слова.
Співвідношення між температурою і середньою кінетичною енергією руху молекул, яке було установлено для ідеального газу, справджується для будь-яких речовин, рух атомів або молекул яких підлягає законам механіки Ньютона. Воно справджується для рідин і твердих тіл, у яких атоми можуть лише коливатись біля положень рівноваги у вузлах кристалічних граток.
Абсолютна температура – фізична скалярна величина, яка визначається середньою кінетичною енергією хаотичного поступального руху молекул.
Абсолютна температура, як видно з формули  не може бути від’ємною, бо всі величини, що стоять у лівій частині формули, явно додатні. Отже, найменше можливе значення температури Т =0, якщо тиск р або V дорівнюють нулю.
не може бути від’ємною, бо всі величини, що стоять у лівій частині формули, явно додатні. Отже, найменше можливе значення температури Т =0, якщо тиск р або V дорівнюють нулю.
Абсолютний нуль температури – це гранична температура, за якої тиск ідеального газу прямує до нуля за умови фіксованого об’єму (або об’єм ідеального газу прямує до нуля за умови незмінного тиску).
Дайте відповідь на запитання
1. Як пов’язані об’єм, тиск і кількість молекул різних газів у стані теплової рівноваги?
2. Запишіть формулу, що показує, як залежить від температури середня кінетична енергія поступального руху молекул.
3. Температура газу збільшилась від 1 оС до 2 оС. Чи можна сказати, що середня кінетична енергія його частинок збільшилась удвоє?
4. Запишіть і поясніть формулу, що показує залежність тиску газу від його температури і концентрації молекул.
5. Що називають абсолютним нулем температури? Який фізичний зміст цього поняття з погляду МКТ?
6. Напишіть значення температури і тиску газу за нормальних умов.
7. Який фізичний зміст сталої Больцмана? Чому вона дорівнює?
Дата публикования: 2014-10-25; Прочитано: 9136 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
