 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Рівняння стану ідеального газу. Об’єднаний газовий закон
|
|
· Рівняння стану ідеального газу. Універсальна газова стала
· Об’єднаний газовий закон
Рівняння стану ідеального газу. Універсальна газова стала. Як зазначалось раніше ідеальний газ є найпростішою термодинамічною системою. Стан газу певної маси повністю визначений, якщо відомі тиск, температура і його об’єм. Ці величини називають параметрами стану газу. Якщо ці параметри змінюються, то в газі відбувається той або інший процес. У природі часто відбуваються процеси, коли одночасно змінюються усі три величини, що характеризують стан газу.
Рівняння стану ідеального газу – це рівняння, що поєднує параметри стану цього газу – 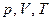 .
.
Слід зазначати, що задовго до того, як рівняння стану ідеального газу було встановлено на основі молекулярно-кінетичних уявлень, закономірності поведінки газів у різних умовах були досить добре дослідженні експериментально. Тому рівняння стану ідеального газу можна розглядати як узагальнення експериментальних фактів, що знаходять своє пояснення у молекулярно-кінетичній теорії.
Нині рівняння стану ідеального газу легко можна вивести з основного рівняння МКТ. Урахувавши рівняння  і співвідношення
і співвідношення 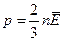 , одержимо ще один вираз основного рівняння МКТ газів:
, одержимо ще один вираз основного рівняння МКТ газів:
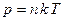 ,
,
де 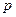 – тиск газу;
– тиск газу;  – концентрація молекул ідеального газу;
– концентрація молекул ідеального газу; 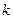 – стала Больцмана;
– стала Больцмана;  – абсолютна температура газу.
– абсолютна температура газу.
Тоді:
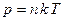
→ 
→ 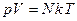
→ 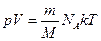 .
.
Добуток відомих вам сталої Авогадро 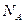 на сталу Больцмана
на сталу Больцмана 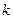 є сталою величиною, яку називають універсальною (молярною) газовою сталою і позначають як
є сталою величиною, яку називають універсальною (молярною) газовою сталою і позначають як  .
.
Підрахуємо значення універсальної газової сталої:
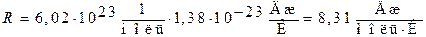 .
.
Остаточно записуємо рівняння, яке містить тільки макроскопічні (термодинамічні) характеристики газу і є результатом основного рівняння МКТ газів. Це рівняння називають ще рівнянням Менделєєва-Клапейрона:
 .
.
Стан газу певної маси повністю визначений, якщо відомі тиск, температура і його об’єм (параметрами стану газу). Рівняння Менделєєва-Клапейрона дає змогу визначити параметри стану ідеального газу будь-якого хімічного складу і довільної маси m. Єдина величина у цьому рівнянні, що залежить від виду газу, – це його молярна маса М.
Якщо врахувати, що густина газу ρ = 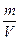 , то рівняння Менделєєва-Клапейрона матиме вигляд:
, то рівняння Менделєєва-Клапейрона матиме вигляд:
р = 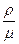 RТ.
RТ.
Або врахувавши, що 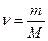 , отримуємо:
, отримуємо: 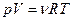 .
.
Для одного моля ( ) довільного газу це співвідношення набуває вигляду:
) довільного газу це співвідношення набуває вигляду: 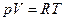 .
.
Виведене на підставі молекулярно-кінетичних уявлень це рівняння підтверджує ще один закон, отриманий у результаті експериментів.
Якщо у рівняння підставити значення тиску і температури, що відповідають нормальним умовам: T= 273,15 К (0 °С), p= 1 атм = 1,013·105 Па, то один моль довільного газу займатиме об’єм V0 = 0,0224 м3 – це твердження називають законом Авогадро.
Для суміші газів рівняння набуває вигляду:  , де ν1, ν2... – кількості речовини кожного із газів суміші.
, де ν1, ν2... – кількості речовини кожного із газів суміші.
Таким чином, рівняння стану дає змогу визначити:
• одну з макроскопічних величин (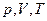 ), знаючи дві інші;
), знаючи дві інші;
• перебіг процесів у системі;
• зміну стану системи під час виконання нею роботи або отримання теплоти від тіл, які її оточують (про це ви детальніше дізнаєтесь при вивчені матеріалу розділу «Термодинаміка»).
Лише за тиску у сотні атмосфер (коли виявляє себе об’єм молекул газу) та за температур зрідження газу (внаслідок великої сили взаємодії молекул) відхилення від результатів розрахунків за рівнянням стану ідеального газу стають істотними.
Об’єднаний газовий закон. У природі часто відбуваються процеси, коли одночасно змінюються усі три параметри, що характеризують стан газу, при цьому маса газу залишається незміною (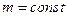 ). Якщо на початку процесу, який відбувається з газом якої-небудь певної маси, позначити через p 1, V 1, T 1, а їх значення в кінці процесу – відповідно через p 2, V 2, T 2, то
). Якщо на початку процесу, який відбувається з газом якої-небудь певної маси, позначити через p 1, V 1, T 1, а їх значення в кінці процесу – відповідно через p 2, V 2, T 2, то
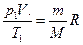 ;
;  .
.
Праві частини обох виразів однакові. Порівнюючи їх ліві частини, отримаємо рівняння, справедливе для газу незмінної маси:
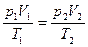 або
або 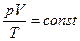 .
.
Воно називається рівнянням Клапейрона і формулюється так: під час переходу газу незмінної маси з одного стану в інший добуток його тиску на об’єм, поділений на термодинамічну температуру газу, є величиною сталою.
  Клапейрон Б.П. Д. І. Менделєєв
Клапейрон Б.П. Д. І. Менделєєв
| Рівняння стану ідеального газу 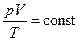 виведене у 1834 р. французьким фізиком Клапейроном Б.П. (1799-1864), який протягом десяти років працював у Росії.
У 1874 р. видатний російський учений Д. І. Менделєєв удосконалив формулу рівняння стану, ввівши макроскопічний параметр – масу газу. Тому рівняння виведене у 1834 р. французьким фізиком Клапейроном Б.П. (1799-1864), який протягом десяти років працював у Росії.
У 1874 р. видатний російський учений Д. І. Менделєєв удосконалив формулу рівняння стану, ввівши макроскопічний параметр – масу газу. Тому рівняння  називають рівнянням Менделєєва-Клапейрона. називають рівнянням Менделєєва-Клапейрона.
|
Співвідношення між значеннями тих чи інших параметрів на початку і в кінці процесу називається газовим законом. Тому рівняння Клапейрона ще називають об’єднаним газовим законом.
Дайте відповіді на запитання
1. Що таке параметри стану системи? Які величини до них належать?
2. Виведіть рівняння Менделєєва-Клапейрона для довільної маси ідеального газу.
3. Виведіть рівняння Клапейрона. Як воно формулюється?
4. Чому дорівнює універсальна газова стала в СІ?
Дата публикования: 2014-10-25; Прочитано: 16595 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
