 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основне рівняння молекулярно-кінетичної теорії ідеального газу
|
|
· Тиск газу в молекулярно-кінетичній теорії
· Виведення основного рівняння молекулярно-кінетичної теорії ідеального газу
· Парціальний тиск
Тиск газу в молекулярно-кінетичній теорії. Тиск газу на оточуючі тіла – найголовніша відмінність газу від рідин і твердих тіл. З курсу фізики 8 класу ви знаєте, що тиск газу на стінки посудини (чи будь-яку іншу поверхню) зумовлений ударами молекул. Молекули газу стикаючись із будь-якими перепонами на їх шляху (стінки посудини, люди, тварини, автомобілі, скелі), діють на них. У результаті удару, наприклад об стінку посудини, кожна молекула передає їй імпульс, а отже, діє на неї з певною (дуже малою) силою. Натомість стінка діє на молекулу з такою самою силою у протилежному напрямі. Коли кількість молекул у посудині мала, ці удари відбуваються зі значними (у молекулярному масштабі) інтервалами часу, і це сприймається не як безперервна дія, а як низка послідовних дуже малих дій. Коли кількість молекул у посудині велика, що реально (крім штучно створюваних умов високого вакууму), ці удари відбуватимуться безперервно. Нескінченно малі дії окремих молекул додаються і результуюча дія сприймається як практично постійно діюча сила.
Таким чином, згідно з молекулярно-кінетичними уявленнями тиск газу виникає в результаті ударів молекул об стінки посудини.
Тиск газу (р) - усереднена за часом результуюча сила дії молекул на одиницю площі посудини.
Це величина, яка характеризує стан великої кількості молекул, тобто макроскопічна величина. У випадку однієї чи кількох молекул поняття тиску взагалі втрачає сенс.
За одиницю тиску в СІ беруть такий тиск, за якого на 1 м2 поверхні на неї діє сила в 1 Н. Цю одиницю називають паскалем: 1 Па = 1 Н/м2.
Використовують і позасистемні одиниці: міліметр ртутного стовпчика (1 мм рт.ст.≈133,3 Па); атмосфера (1 атм≈105 Па).
Вимірюють тиск газу нижчий і вищий від атмосферного за допомогою манометрів, атмосферний – барометрами.
Оскільки величезна кількість молекул газу рухається хаотично, то відбувається у середньому однакова кількість ударів у будь-якому напрямі, а отже, тиск на всі стінки посудини має бути однаковим, на що вказує закон Паскаля.
Виведення основного рівняння молекулярно-кінетичної теорії ідеального газу. Використовуючи модель ідеального газу, німецький фізик Рудольф Клаузіус вивів рівняння, що встановлює зв’язок між тиском ідеального газу p, масою молекули m0, концентрацією молекул n і середнім квадратом швидкості  .
.
 Рудольф Клаузіус
Рудольф Клаузіус
|
Точне виведення рівняння молекулярно-кінетичної теорії досить складне, зрозуміти його і запам’ятати нелегко. Доказ майже кожного твердження у фізиці, виведення будь-якого рівняння можна виконати з різним ступенем точності і переконливості: дуже спрощено, більш-менш точно і з великою точністю, доступною сучасному стану розвитку науки. Ми обмежимось дуже спрощеним, схематичним виведенням рівняння.
Нехай всередині посудини, площа стінки якої S міститься ідеальний одноатомний газ з молекулами масою  кожна, які хаотично рухаються. Згідно статистичних закономірностей можна вважати, що кожна молекула має одну й ту саму швидкість, значення якої відповідає середній квадратичній швидкості руху сукупності молекул
кожна, які хаотично рухаються. Згідно статистичних закономірностей можна вважати, що кожна молекула має одну й ту саму швидкість, значення якої відповідає середній квадратичній швидкості руху сукупності молекул
 .
.
Як відомо, вектор швидкості  має три складові
має три складові 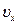 ,
,  ,
, 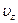 вздовж взаємно перпендикулярних осей Oх, Oу, Oz у декартовій системі координат (мал. 12).
вздовж взаємно перпендикулярних осей Oх, Oу, Oz у декартовій системі координат (мал. 12).

Мал. 12. Проекції вектора швидкості  на осі системи координат
на осі системи координат
Квадрат вектора швидкості пов’язаний з його компонентами таким співвідношенням:  .
.
Таке ж співвідношення справедливе і для середнього квадрату швидкості:  .
.
Повна хаотичність руху дозволяє стверджувати, що рух за всіма напрямами відбувається з однаковою швидкістю, тому  , а отже
, а отже  , звідки
, звідки
 .
.
Припустімо, що молекули газу рухаються від однієї стінки до іншої без взаємних зіткнень. Це спрощення внаслідок великої кількості молекул  і хаотичності їх руху не впливає на точність розрахунків. Під час зіткнення зі стінками посудини молекули ідеального газу взаємодіють з ними за законами механіки як абсолютно пружні тіла. Молекула діє на стінку із силою
і хаотичності їх руху не впливає на точність розрахунків. Під час зіткнення зі стінками посудини молекули ідеального газу взаємодіють з ними за законами механіки як абсолютно пружні тіла. Молекула діє на стінку із силою 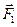 , що дорівнює за третім законом Ньютона силі
, що дорівнює за третім законом Ньютона силі  , з якою стінка посудини діє на молекулу і протилежна їй за напрямом.
, з якою стінка посудини діє на молекулу і протилежна їй за напрямом.
Нехай молекула масою  рухається зі швидкістю
рухається зі швидкістю  в напрямі стінки посудини, площа якої
в напрямі стінки посудини, площа якої  (мал. 13).
(мал. 13).

Мал. 13. Пружний удар молекули об стінку посудини у виділеному об’ємі
Пружно вдарившись об стінку, вона передає їй імпульс:  . Оскільки взаємодія пружна, тобто модуль швидкості не змінюється, а напрям руху змінюється на протилежний
. Оскільки взаємодія пружна, тобто модуль швидкості не змінюється, а напрям руху змінюється на протилежний  , то
, то  .
.
Якщо швидкість руху молекули направлена під довільним кутом до стінки, то під час зіткнення молекули із стінкою проекція її швидкості на напрям, перпендикулярний до поверхні стінки, змінює знак  , а проекції швидкостей
, а проекції швидкостей  та
та  на напрями, паралельні поверхні стінки лишаються без змін. Таким чином зміна проекції імпульсу молекули дорівнює:
на напрями, паралельні поверхні стінки лишаються без змін. Таким чином зміна проекції імпульсу молекули дорівнює: 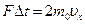 .
.
Щоб обчислити імпульс сили, що діє на стінку з боку молекул, необхідно підрахувати кількість зіткнень молекул із стінкою за час  .
.
За час  стінки посудини можуть досягти лише ті молекули, які знаходяться в об’ємі:
стінки посудини можуть досягти лише ті молекули, які знаходяться в об’ємі:
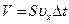 .
.
Оскільки в цьому об’ємі половина молекул рухається до стінки, а половина від неї, то кількість молекул  , які вдаряться об стінку за час
, які вдаряться об стінку за час  , буде дорівнювати:
, буде дорівнювати:
 ,
,
де  – концентрація молекул.
– концентрація молекул.
Підставивши значення об’єму  отримаємо:
отримаємо:
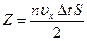 .
.
Усі ці молекули передадуть стінці імпульс, що згідно з другим законом Ньютона дорівнює імпульсу сили:
 або з урахуванням попереднього виразу
або з урахуванням попереднього виразу 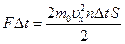 .
.
Після спрощень, сила  , з якою діють молекули на стінку площею
, з якою діють молекули на стінку площею  , дорівнює:
, дорівнює:
 .
.
Оскільки швидкості молекул різні, і кожна з них, ударяючись об стінку вносить свій особливий вклад у тиск, то беруть середнє за всіма молекулами значення квадрата проекції швидкості 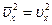 .
.
Врахувавши, що  , а тиск
, а тиск  , то одержимо вираз основного рівняння молекулярно-кінетичної теорії газів:
, то одержимо вираз основного рівняння молекулярно-кінетичної теорії газів:
 .
.
Основне рівняння МКТ газів установлює зв’язок між тиском (макроскопічним параметром) з такими мікроскопічними параметрами, як маса однієї молекули і середня квадратична швидкість руху молекул. Дає можливість, знаючи масу молекули  , визначити середню квадратичну швидкість
, визначити середню квадратичну швидкість  і концентрацію молекул
і концентрацію молекул  , розрахувати тиск, який чинить газ на стінку посудини, в якій він знаходиться.
, розрахувати тиск, який чинить газ на стінку посудини, в якій він знаходиться.
Це рівняння можна подати і в іншому вигляді. Поділимо і помножимо праву частину рівняння на 2:  .
.
Звідси можна зробити важливий висновок: тиск ідеального газу пропорційний середній кінетичній енергії хаотичного руху молекул.
Або, врахувавши, що 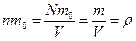 , отримуємо:
, отримуємо:  .
.
Основне рівняння МКТ газів підтверджує той факт, що чим більша маса молекул і їх швидкості, а також концентрація, тим більший тиск вони чинять на стінки посудини.
Це рівняння – перше кількісне співвідношення, добуте в молекулярно-кінеимчній теорії, тому його називають основним. Після виведення цього рівняння в середині ХІХ ст. й експериментального доведення його справедливості розпочався швидкий розвиток кількісної молекулярно-кінетичної теорії, який триває і досі.
Парціальний тиск. Якщо газ складається із суміші ідеальних газів, молекули кожного газу ударяють об стінку посудини незалежно одна від одної.
Парціальний тиск – це тиск, що його чинив би газ, який входить до складу суміші газів, коли б один при даній температурі займав увесь об'єм.
Відповідно до принципу суперпозиції сил, тиски газів, які складають суміш (парціальні тиски), додаються. Це твердження вперше сформулював у 1801 р. англійський фізик і хімік Д. Дальтон (1766 – 1844), тому його називають законом Дальтона.
Закон Дальтона: тиск суміші газів дорівнює сумі парціальних тисків складових газів:
р = р1 + р2 +... +рп.
Строго виконується для суміші ідеальних газів; наближено застосовується для реальних газів при певних значеннях температур і тисків (далеких від критичних). Так, атмосферний тиск складається із парціальних тисків азоту, кисню та інших газів.
 Джон Дальтон (1766-1844)
Джон Дальтон (1766-1844)
|
Дайте відповіді на запитання
1. Який механізм виникнення тиску газу з погляду МКТ?
2. Виведіть і поясніть фізичний зміст основного рівняння МКТ.
3. Які особливості основного рівняння ідеального газу і чому його називають основним?
4. Які існують інші форми запису основного рівняння МКТ газів? Що таке парціальний тиск? У чому полягає суть закону Дальтона?
Дата публикования: 2014-10-25; Прочитано: 8764 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
