 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ідеальний газ у молекулярно-кінетичній теорії
|
|
· Ідеальний газ
· Мікроскопічні і макроскопічні параметри газу
· Поняття про статистичні закономірності
Ідеальний газ. Як ви вже знаєте, при вивченні фізичних явищ використовують метод моделювання. При цьому факторами, які не мають суттєвого впливу на хід явища нехтують і теоретично досліджують ідеалізоване явище. Створена модель явища допомагає вивчати процеси, що відбуваються реально, і передбачати їх хід у різних випадках.
Сформульовані вище основні положення молекулярно-кінетичної теорії речовини спочатку застосуємо до найпоширенішого і найпростішого за будовою стану речовини – газоподібного. Для виконання цього завдання будемо використовувати модель реального газу - ідеальний газ.
У цій моделі передбачається:
а) силами міжмолекулярної взаємодії можна знехтувати;
б) взаємодія між молекулами відбувається тільки під час зіткнення молекул і є пружною взаємодією, між зіткненнями молекули рухаються рівномірно і прямолінійно;
в) власним об’ємом молекул можна знехтувати, тобто вважати молекули матеріальними точками.
Ідеальний газ – це модель реального газу, у якій молекули можна вважати матеріальними точками які майже не взаємодіють між собою.
За її допомогою на основі здобутих експериментальних результатів із дослідження газів була побудована молекулярно-кінетична теорія газів. Поняття ідеального газу корисне в тому відношенні, що реальні гази набувають властивостей ідеального газу при значному розрідженні, коли середня відстань між молекулами набагато більша за їх розмір. Більшість реальних газів при кімнатній температурі й нормального атмосферного тиску є близькими за своїми властивостями до ідеального газу. Найближчими до ідеального газу є водень і гелій за нормальних умов.
За високих тисків і низьких температур реальний газ не може вважатися ідеальним, бо молекули газу зближуються так, що сили притягання починають відігравати помітну роль. Істотно впливає на поведінку молекул за цих умов і власний об’єм молекул. Поведінка реального газу в такому випадку описується законами, що відрізняються від законів ідеального газу.
Надалі досліджуючи властивості газу маємо на увазі саме ідеальний газ (навіть якщо термін «ідеальний» не вказано).
Мікроскопічні і макроскопічні параметри газу. Вивчення основних властивостей газів на основі молекулярно-кінетичної теорії базується на встановленні кількісних зв’язків між величинами, які вимірюються експериментально (тиском, температурою та іншими), і властивостями самих молекул – їх масою, швидкістю руху тощо.
Індивідуальні характеристики молекул газу називають мікроскопічними параметрами. До них відносяться маса молекул, їх швидкість і кінетична енергія хаотичного поступального руху. Параметри газу, як молекулярної системи, що складається з величезної кількості частинок, називаються макроскопічними параметрами. До них відносяться об’єм, тиск і температура.
Іншими словами, одним із завдань молекулярно-кінетичної теорії газів є встановлення зв’язку між макроскопічними і мікроскопічними параметрами газу.
Поняття про статистичні закономірності. У молекулярній фізиці ми маємо справу з явищами, зумовленими дією занадто великої кількості частинок. Наприклад, в 1 см3 газу за нормальних умов міститься  молекул. При цьому кожна молекула зазнає близько мільярда зіткнень за секунду, внаслідок чого постійно змінюється її швидкість і напрям руху. Навіть, якщо нам вдасться дослідити закономірності руху однієї молекули, стверджувати що ці закономірності властиві усій сукупності молекул не можна! Механічний рух сукупності молекул має якісно інші властивості порівняно з тим, які має окрема молекула.
молекул. При цьому кожна молекула зазнає близько мільярда зіткнень за секунду, внаслідок чого постійно змінюється її швидкість і напрям руху. Навіть, якщо нам вдасться дослідити закономірності руху однієї молекули, стверджувати що ці закономірності властиві усій сукупності молекул не можна! Механічний рух сукупності молекул має якісно інші властивості порівняно з тим, які має окрема молекула.
Закони молекулярної фізики ґрунтуються на статистичних методах, які дають можливість досліджувати системи, що складаються із великої сукупності частинок. Фізичні закономірності таких систем мають імовірнісний, статистичний характер.
Один із прийомів статистичного методу – обчислення середніх значень різних величин, що зазнають індивідуальних змін. Так, досліджуючи рух сукупності молекул газу немає потреби визначати швидкість і кінетичну енергію поступального руху кожної окремої молекули, статистичний метод дає змогу обчислити середнє значення цих величин для даної сукупності молекул. Швидкості окремих молекул можуть бути будь-якими, проте середнє значення модуля швидкості руху молекул – певна величина. Щоб її визначити, треба додати значення швидкості руху всіх молекул і поділити цю суму на кількість молекул:  (обчислене у такий спосіб середнє значення величини позначають рискою над її буквеним символом).
(обчислене у такий спосіб середнє значення величини позначають рискою над її буквеним символом).
Але надалі нам буде потрібно середнє значення не самої швидкості, а квадрата швидкості. Від цієї величини залежить середня кінетична енергія молекул. А середня кінетична енергія молекул, як ми незабаром впевнимось, має дуже велике значення в усій молекулярно-кінетичній теорії.
Отже, середній квадрат швидкості дорівнює:

де  - модулі швидкостей окремих молекул, N – їх кількість у газі.
- модулі швидкостей окремих молекул, N – їх кількість у газі.
Середня квадратична швидкість руху молекул (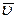 ) – це величина, яка визначається коренем квадратним із середнього квадрата швидкості:
) – це величина, яка визначається коренем квадратним із середнього квадрата швидкості:  .
.
Середня квадратична швидкість є характеристикою хаотичного невпорядкованого руху молекул тому її ще називають тепловою.
У молекулярній фізиці також широко використовуються закони теорії ймовірності. Це звільняє від потреби знати точне значення тих чи інших фізичних величин: досить мати відомості про найімовірніші значення цих величин. Так, визначити скільки молекул газу, що знаходиться у посудині, мають швидкість, наприклад 300 м/с, неможливо. Ми можемо лише встановити, яка частина молекул має швидкість, що лежить у інтервалі від 290 до 310 м/с.
Молекулярно-кінетична теорія ідеального газу, користуючись методами статистики, дає змогу вивести газові закони, пояснити властивості газів і процесів, що відбуваються в газах.
Дайте відповіді на запитання
1. Що називають ідеальним газом?
2. Назвіть умови, за яких газ можна вважати ідеальним.
3. Які величини називають мікроскопічними та макроскопічними параметрами газу?
4. Про статистичні методи
Дата публикования: 2014-10-25; Прочитано: 7079 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
