 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ионо- и молекулярноселективные электроды определения
|
|
Для измерения концентрации биологически активных ионов: Н+, Na+, К+, NH4(+), Са2+, NO3(-) и других, а также различных веществ в биологических системах используют электроды определения, которые называют также индикаторными электродами. Потенциалы этих электродов зависят в основном от концентрации определяемого иона или вещества. Электродами определения прежде всего являются ионоселективные электроды, действие которых основано на возникновении мембранного потенциала на мембране с селективной чувствительностью к данному иону.
Подобная мембрана способна адсорбировать или пропускать только определенный ион. Ионоселективные электроды определения (рис. 25.8) представляют собой электрохимическую систему, внутри которой находится раствор с
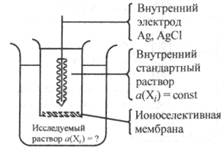 |
Рис. 25.8. Устройство ионоселективного электрода
известной постоянной активностью определяемого иона (aBH(Xi) = = const). В этот раствор опущен внутренний электрод сравнения с постоянным значением потенциала. В качестве внутреннего электрода обычно используют хлорсеребряный электрод. Контакт этой системы с исследуемым раствором осуществляется через ионоселективную мембрану. На внутренней и наружной поверхностях данной мембраны возникают потенциалы фвн и Фнар, которые согласно известному уравнению Нернста прямо пропорциональны логарифму активности определяемого иона во внутреннем и исследуемом растворах соответственно. Для измерения возникающих мембранных потенциалов в исследуемый раствор опускают внешний хлорсеребряный электрод сравнения. Полученную гальваническую цепь измерительной системы можно записать следующим образом:

 |
Потенциал ионоселективного электрода определяется суммой потенциалов на каждой границе раздела: ф = ф1+ фвн + фнар. Поскольку потенциалы ф1 и фвн постоянны, а значение
 |
прямо пропорционально логарифму активности анализируемого иона Xi; в исследуемом растворе, то и ЭДС гальванической цепи будет линейной функцией показателя активности этого иона в растворе, так как рХl = -lg а(Хi). Таким образом, измерив ЭДС гальванической цепи из ионоселективного электрода определения и электрода сравнения, опущенных в исследуемый раствор, можно определять в нем эффективную концентрацию анализируемого иона. ЭДС гальванической цепи определяют с помощью иономера (рис. 25.9). Это высокочувствительный милливольтметр, шкала которого проградуирована в единицах pXl. Иономер имеет разные диапазоны для грубых и точных измерений определяемых величин.
 |
Все ионоселективные электроды в зависимости от агрегатного состояния мембран подразделяются на электроды с твердыми и жидкими мембранами. Наиболее широко используемым ионоселективным электродом определения с твердой мембраной является стеклянный электрод. Стеклянный электрод представляет собой трубку, заканчивающуюся тонкостенной стеклянной мембраной в виде шарика, чувствительной к определенному виду ионов. Внутри находится раствор, содержащий данный вид ионов, в который опущен внутренний электрод сравнения, соединяемый с внешней цепью. Чаще всего используется стеклянный электрод, чувствительный к ионам Н+ и поэтому позволяющий определить рН раствора. В этом случае внутренним раствором является 0,1 М раствор НСl, а стеклянную мембрану (шарик) изготавливают из специального литийбарийсиликатного стекла (рис. 25.10).
Чтобы повысить чувствительность стеклянной мембраны к ионам Н+, стеклянный электрод после хранения необходимо вымочить в разбавленном растворе НС1 и далее сохранять в дистиллированной воде. При вымачивании стеклянной мембраны в кислоте поверхность стекла гидратируется, ионы щелочного металла в стекле обмениваются на ионы водорода Н+, находящиеся в растворе:

 |
В результате на каждой границе стекло - раствор возникает свой двойной электрический слой, характеризующийся потенциалом, зависящим от активности ионов Н+. Между внутренней и наружной поверхностями мембраны появляется разность потенциалов, которая
Рис. 25.10. Стеклянный электрод для измерения рН
зависит в основном от активности ионов Н+ в исследуемом растворе, так как внутренний раствор имеет постоянную активность ионов Н+. Для измерения этой разности потенциалов необходимо составить гальваническую систему из стеклянного электрода, содержащего обычно внутренний хлорсеребряный электрод, и внешнего электрода сравнения:

где ф1 + фвн = const, так как включает постоянные потенциалы электрохимической системы стеклянного электрода. Величина фнарсогласно уравнению Нернста равна фнар= (2,SRT/F) lg а(Н+) = -2 • 10-4 Т рН, поэтому 
Таким образом, потенциал стеклянного электрода является функцией рН исследуемого раствора, и ЭДС гальванической цепи из стеклянного электрода и электрода сравнения тоже будет функцией рН исследуемого раствора:
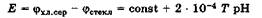
Полученное выражение свидетельствует о линейной зависимости ЭДС гальванической цепи от рН исследуемого раствора. Так как постоянная величина, входящая в это выражение, неизвестна, то перед измерением рН с помощью конкретного стеклянного электрода необходимо откалибровать этот электрод по стандартным буферным растворам с точно известным значением рН, корректируя показания шкалы рН-метра, являющегося, по сути, точным милливольтметром. Таким образом, рН-метры позволяют с помощью откалиброванного стеклянного электрода и электрода сравнения измерять рН исследуемого раствора непосредственно по шкале прибора.
Аналогично измерению рН с помощью стеклянных ионосе-лективных электродов, мембрана которых изготовлена из определенного сорта стекла, селективного по отношению к ионам Na+, К+ или NH4(+), можно определять концентрацию этих ионов непосредственно в биологических системах.
На основе мембраны из кристаллического фторида лантана созданы фторидселективные электроды для определения концентрации фторид-иона в молоке, моче и в зубной пасте.
 |
Ионоселективные электроды с жидкой мембраной состоят из мелкопористой диафрагмы из стекла или пластмассы, пропитанной раствором ионофора в нелетучем органическом растворителе, не смешивающимся с водой. Селективность такой мембраны зависит от комплексообразующих свойств ионофора по отношению к определяемому иону на фоне других ионов, находящихся в анализируемой системе. Среди ионоселективных электродов определения с жидкой мембраной наиболее широкое применение нашли калиевый, кальциевый, нитратный и ацетилхолиновый электроды (табл. 25.2).
В последнее время наряду с ионоселективными электродами в биохимических анализах применяют молекулярноселективные электроды. Молекулярноселективные электроды определения представляют собой ионо-селективные электроды, на наружной поверхности мембран которых нанесен слой иммобилизованного фермента. Ферменты - вещества, которые способны катализировать превращения одного-единственного субстрата из многих сотен или даже тысяч веществ близкой химической природы. Под действием фермента происходит реакция с определяемым субстратом, приводящая к образованию иона, к которому чувствителен данный электрод определения. Такие электроды часто называют ферментными. Например, мочевино-селективный электрод состоит из аммоний-селективного стеклянного электрода, покрытого слоем, содержащим фермент уреа-зу. Под действием уреазы мочевина CO(NH2)2 в исследуемом растворе гидролизуется с образованием иона аммония, концентрация которого фиксируется аммоний-селективным стеклянным электродом, и тем самым определяется содержание мочевины в исследуемом растворе.
С помощью фермента пенициллиназы, нанесенного на поверхность мембраны стеклянного электрода для измерения рН, можно определять концентрацию пенициллина в исследуемом растворе. Пенициллин под действием пенициллиназы количественно превращается в пенициллиновую кислоту, что изменяет рН среды пропорционально содержанию пенициллина и фиксируется стеклянным электродом.
В настоящее время в клинической практике широко используются молекулярноселективные электроды, содержащие ферменты для определения глюкозы, антибиотиков, витаминов, гормонов, аминокислот и других биологически активных веществ. Разрабатываются иммуноэлектроды для определения содержания антигенов или антител.
Кроме ионо- и молекулярноселективных электродов в потенцио-метрии в качестве электрода определения используют окислительно-восстановительный электрод определения на основе платины для исследования ионного состава различных сопряженных окислительно-восстановительных пар.
С помощью рассмотренных электродов определения потенциометрически определяют непосредственно активности и концентрации соответствующих ионов или веществ в исследуемых системах. Такая методика называется прямой потенциометрией (см. рис. 25.9). При прямой потенциометрии предварительно обязательно калибруют электрод определения. Для этого с помощью данного электрода определения проводят измерения серии стандартных растворов с известной концентрацией определяемого иона или вещества. По полученным данным или строят калибровочный график в координатах Е = f(рХi), или корректируют шкалу иономера для измерения pXj. Таким образом, откорректированный рН-метр или иономер позволяют с помощью откалиброванного электрода определения измерить рН или рХl непосредственно по шкале прибора.
Прямая потециометрия с использованием ионо- и молекулярноселективных электродов определения широко применяется в клинической и санитарной практике.
Дата публикования: 2014-10-16; Прочитано: 5393 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
