 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Восстановительный потенциал
|
|
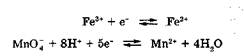 |
В сопряженных окислительно-восстановительных парах, например:
 |
обмен электронами между восстановленной и окисленной формами в растворах наиболее вероятен через посредника. Им может быть любой проводник, полупроводник или диполь. В качестве стандартного посредника используют инертный металл платину. Платина, выполняя в этих случаях только роль проводника электронов, способствует перераспределению электронов между восстановленной и окисленной формами данной сопряженной системы. Обмен электронами между восстановленной и окисленной формами через платину сопровождается появлением на границе раздела фаз платина -раствор двойного электрического слоя. Возникновение ДЭС в этом случае не связано с природой посредника, а вызывается различием в способности восстановленной формы отдавать электроны посреднику, а окисленной формы - принимать электроны от него. Знак заряда на платине зависит от того, скорость какого процесса -отдачи электронов (окисления) или присоединения электронов (восстановления) - в данной сопряженной окислительно-восстановительной паре до наступления равновесия будет больше.
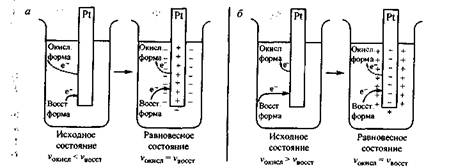
Рис. 25.4. Возникновение потенциала в системе раствор, содержащий окислительно-восстановительную пару/платиновый электрод:
а - первоначально преобладает процесс восстановления (<-);
b - первоначально преобладает процесс окисления (—>)
Если в начальный момент преобладает процесс присоединения электронов окисленной формой (восстановление), то на платине возникает дефицит электронов, и металл заряжается положительно, а раствор - отрицательно (рис. 25.4, а). В тех случаях, когда в начальный момент преобладает процесс отдачи электронов восстановленной формой (окисление), то на платине создается избыток электронов и металл заряжается отрицательно, а раствор - положительно (рис. 25.4, б).
В результате появления зарядов на границе раздела фаз ускоряется медленный и тормозится быстрый процесс перераспределения электронов, пока не наступит состояние химического равновесия. С установлением равновесия в системе стабилизируется распределение зарядов в ДЭС, которое характеризуется определенным значением потенциала, называемого восстановительным.
Восстановительным потенциалом называется потенциал, который возникает в системе, состоящей из инертного металла и раствора, содержащего сопряженную окислительно-восстановительную пару. Эта система называется окислительно-восстановительным электродом.
Восстановительный потенциал обозначается ф(ок,восст). Наличие запятой между формами показывает, что междуними в растворе нет поверхности раздела. Окислительно-восстановительный электрод в гальванической цепи принято записывать так: химический символ инертного металла, вертикальная черта, указывающая на межфазную границу, за которой следуют через запятую формулы веществ или ионов, составляющих сопряженную окислительно-восстановительную пару. Например: Pt / Fe3+, Fe2+ или Pt | MnO4(-), H+, Mn2+.
На значение восстановительного потенциала влияют:
- природа сопряженной окислительно-восстановительной пары;
- соотношение активностей окисленной и восстановленной форм в растворе;
- температура.
Стандартным восстановительным потенциалом Ф°(ок, восст) называется потенциал окислительно-восстановительного электрода, возникающий на платине при стандартных условиях: Т = 298 К, р = 101 325 Па и активностях окисленной и восстановленной форм в растворе, равных 1 моль/л.
Величина стандартного восстановительного потенциала является мерой окислительной способности сопряженной окислительно-восстановительной пары (см. табл. 9.1). Чем больше  тем сильнее выражена у окисленной формы данной пары спосоОность присоединять электроны, т. е. способность восстанавливаться.
тем сильнее выражена у окисленной формы данной пары спосоОность присоединять электроны, т. е. способность восстанавливаться.
Для определения потенциала окислительно-восстановительного электрода необходимо составить гальваническую цепь из исследуемого электрода и электрода сравнения, соблюдая условие: Фкатода > > ф анода. Рассмотрим это на примере определения стандартного восстановительного потенциала системы Sn4+, Sn2+ - ф° (Sn4+, Sn2+). Если в качестве электрода сравнения использовать стандартный водородный электрод, он будет анодом, а исследуемый электрод -катодом, так как процесс окисления в системе 2Н+, Н2 протекает легче, чем в системе Sn4+, Sn2+:
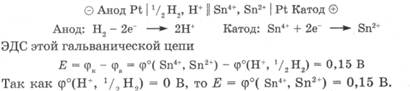
Значения стандартных восстановительных потенциалов некоторых систем в водных растворах приведены в табл. 9.1.
Необходимо отметить, что если восстановительный потенциал системы имеет положительное значение, то в этой системе сильнее выражены окислительные свойства, а если отрицательное, то преобладают восстановительные свойства относительно системы Н+ 1/2 Н2. При взаимодействии двух сопряженных окислительно-восстановительных систем окислителем всегда является та система, восстановительный потенциал которой больше.
При нестандартных условиях значение восстановительного потенциала с учетом влияния природы окислительно-восстановительной пары, температуры и активности компонентов в растворе вычисляют по уравнению Нернста - Петерса:
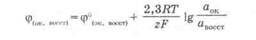
где z- число электронов, участвующих в обратимом окислительно восстановительном процессе, протекающем на электроде; аок, авосст -активность окисленной и восстановленной форм в растворе.
Если в сопряженную окислительно-восстановительную систему входят ионы Н+ или ОН-, то потенциал такой системы зависит от активности этих ионов в растворе. Для подобных стандартных окислительно-восстановительных систем активность соответствующих ионов должна составлять: а(Н+) = 1 моль/л, т. е. рН = 0, или а(ОН-) = 1 моль/л, т. е. рН = 14. При вычислении потенциала этих систем в уравнении Нернста - Петерса учитывается активность данных ионов в растворе, например:

Таким образом, в подобных системах наблюдается взаимосвязь между окислительно-восстановительными и кислотно-основными свойствами. Увеличение кислотности среды способствует усилению окислительных свойств, а уменьшение кислотности — усилению восстановительных свойств этих систем.
Окислительно-восстановительные реакции в организме обычно протекают в нейтральной среде. Поэтому в биохимии для характеристики биологических окислительно-восстановительных систем широко используется нормальный восстановительный потенциал ф0', измеренный при рН = 7, т. е. в условиях физиологической среды (см. табл. 9.2).
Дата публикования: 2014-10-16; Прочитано: 3389 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
