 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Абсорбция
|
|
Абсорбция играет важную роль в обмене веществ, включая газообмен биосистем с окружающей средой. Процессы абсорбции лежат в основе технологических процессов обработки пищевых продуктов, очистки лекарственных препаратов от примесей, очистки выбросов промышленных предприятий в окружающую среду.
Абсорбцией называется самопроизвольное поглощение веществ, при котором поглощаемые вещества (абсорбаты) в результате диффузии распределяются по всему объему вещества-поглотителя (абсорбента).
При обратимой абсорбции в системе газ - жидкость или жидкость - жидкость происходит равновесное распределение поглощаемого вещества между контактирующими фазами в гетерогенной системе. Это равновесие характеризуется константой абсорбционного равновесия, называемой константой распределения Краспр, которую рассчитывают по формуле:
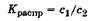
где с1,с2 - концентрация поглощаемого вещества в абсорбенте и в окружающей среде соответственно.
Значение константы распределения зависит от природы контактирующих фаз и температуры.
Абсорбция подчиняется закономерности "подобное с подобным", поэтому концентрация поглощаемого вещества будет больше в той фазе, природа которой ближе к природе поглощаемого вещества, т. е. полярное вещество хорошо абсорбируется полярной фазой, а неполярное вещество - неполярной фазой. Например, хлороводород хорошо абсорбируется водой, а кислород -перфтордекалином (C10F22 _ основа эмульсионного кровезаменителя).
При больших значениях Краспр поглощаемое вещество в основном связано с абсорбентом, и концентрация его в окружающей среде незначительна.
При низких значениях Kpacnp процесс десорбции вещества преобладает над процессом абсорбции, и поэтому вещество преимущественно будет находиться в окружающей среде.
К процессам абсорбции можно отнести растворение вещества в растворителе, который можно назвать абсорбентом. Закономерности абсорбционного распределения веществ важны для понимания процесса обмена веществ в организме. Поступление питательных веществ и выведение продуктов метаболизма через клеточные мембраны подчиняются закону распределения этих веществ между неполярной фазой липидного слоя мембран и полярными фазами внутри- и межклеточной жидкостей. Водонерастворимые соединения: жиры, барбитураты, многие анестетики - хорошо растворимы в липидах, и поэтому они абсорбируются липидным слоем мембран, изменяя их физиологические свойства.
Если поглощаемое вещество - газ, то его абсорбция сопровождается резким изменением объема системы в целом. Поэтому в соответствии с принципом Ле Шателье абсорбция газов в жидкости при увеличении давления возрастает и подчиняется закону Генри.
При постоянной температуре абсорбция газа в единице объема жидкости прямо пропорциональна парциальному давлению этого газа в газовой смеси над жидкостью.

где с - концентрация газа в жидкости, моль/л; р(Х) - парциальное давление газа в смеси, Па или мм рт. ст.; k - константа абсорбционного равновесия.
Парциальным давлением газа р(Х) называется часть общего давления (р0бщ), которая соответствует молярной доле n(Х) газа в смеси: р(Х) = р0бщn(Х). Так, парциальное давление основных компонентов сухого воздуха составляет (в мм рт. ст.): N2 - 594, O2 - 160, СО2 - 0,2, а воздуха, выдыхаемого человеком, соответственно: N2 - 520, 02 - 142, С02 - 38, Н20 - 53.
Закон Генри позволяет понять возникновение профессиональных заболеваний у водолазов, рабочих в кессонах, летчиков, космонавтов, которые должны переходить из газовой среды с большим давлением в среду с меньшим давлением. Во время пребывания человека в среде с высоким давлением кровь и ткани насыщаются газовыми компонентами среды, а при резком понижении давления снижается растворимость абсорбированных газов в крови. В результате снижения растворимости газов из крови выделяются пузырьки этих газов, которые закупоривают капиллярные кровеносные сосуды, вызывая кессонную болезнь. При этом особенно велик вклад азота, так как его объемная доля в воздухе составляет 78 %. Для борьбы с этим явлением снижение давления газовой смеси, в которой находится человек, до нормального должно проводиться медленно. Кроме того, безопаснее использовать дыхательную смесь на основе гелия вместо азота, содержащую 80 % гелия и 20 % кислорода, так как растворимость гелия в крови почти в три раза меньше, чем азота.
Для характеристики растворимости газа в жидкости используют коэффициент абсорбции - это объем газа, приведенный к стандартным условиям, который растворим в единице объема жидкости при указанных температуре и давлении, -а(Х), л газа / л жидкости.
Значение коэффициента абсорбции газа в воде существенно зависит не только от полярности его молекул, но и от способности газа к химическому взаимодействию с водой. Например, значения коэффициента абсорбции а(Х) для газов воздуха в воде при нормальных условиях составляют: N2 - 0,024, 02 - 0,05, С02 - 1,7; а для газов-токсикантов - S02 - 80, НСl - 500, NH3 -1300. Таким образом, токсичность газов-токсикантов связана прежде всего с их лучшей растворимостью в водных средах, так как при их попадании в организм и гидратации в биосредах происходит резкое увеличение содержания "связанной воды" за счет исчезновения "свободной" и уменьшения количества "деструктурированной воды" (разд. 6.1, 11.3 и 11.4). Кроме того, проявляется химическая специфичность токсикантов, приводящая к изменению химических свойств биосред. Так, в присутствии S02 прежде всего усиливаются кислотные свойства водной среды: 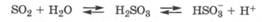
особенно в присутствии кислорода:

Усиление кислотных свойств происходит и под действием газообразного НСl.
 |
В случае абсорбции N02 также усиливаются кислотные свойства среды:
но главная причина его высокой токсичности - окислительные свойства N02, N03(-)и N02(-), приводящие к окислению гемоглобина в метгемоглобин и связыванию гемоглобина в комплекс с продуктом их восстановления N0 (разд. 10.4).
Под действием NH3 возрастает основность водной среды:

Кроме того, NH3 - активный лиганд, склонный к комплексообразованию с "металлами жизни".
Абсорбируемость газа жидкостью зависит не только от природы газа, его давления и температуры, но и от состава жидкости. Абсорбция газов в растворах электролитов подчиняется закону Сеченова.
Растворимость газов в жидкостях в присутствии электролитов понижается вследствие высаливания газов.

где Со - растворимость газа в чистой воде; с - растворимость газа в присутствии электролита; сэл - концентрация электролита; kc - константа Сеченова.
Значение константы Сеченова зависит от природы газа, ионной силы раствора электролита и температуры. Понижение растворимости газа в растворе электролита связано с процессом сольватации ионов, который приводит к уменьшению числа свободных молекул растворителя (разд. 11.4). Уменьшению растворимости газов в воде способствуют также белки, которые чрезвычайно интенсивно подвергаются гидратации, что важно для биологических систем.
Дата публикования: 2014-10-16; Прочитано: 3349 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
