 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Хлорсеребряный электрод сравнения
|
|
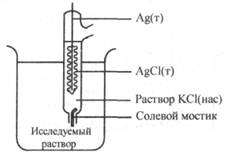
Хлорсеребряный электрод (рис. 25.7) состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствор КСl определенной концентрации (обычно насыщенный раствор КСl) и солевого мостика, соединяющего этот раствор с исследуемым раствором. Электрохимическая цепь хлорсеребряного электрода записывается так: Ag | AgCl, КСl(нас).
 |
В хлорсеребряном электроде на межфазной границе протекает следующая реакция:
Так как активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов Сl- в растворе. Если активность ионов Сl- поддерживать постоянной, то и потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор КСl, в котором а(Сl-) = const. В этом случае потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду при 25 °С фхл.сер = 0,197 В.
 |
В гальваническом элементе хлорсеребряный электрод в зависимости от потенциала второго электрода может быть как анодом, так и катодом. В случае анода протекают реакции окисления серебра и взаимодействия его катиона с
Рис. 25.7. Хлорсеребряный электрод сравнения
 анионом хлора с образованием осадка AgCl:
анионом хлора с образованием осадка AgCl:

В случае катода в системе происходит растворение осадка AgCl и восстановление катионов Ag+:

Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
До недавнего времени в качестве электрода сравнения широко использовался каломельный электрод Hg | Hg2Cl2, Сl-, который устроен аналогично хлорсеребряному электроду. На поверхность ртути нанесен слой малорастворимой соли Hg2Cl2 (каломель). Над поверхностью каломели находится насыщенный раствор КСl, который определяет растворимость Hg2Cl2, а следовательно, и концентрацию ионов Hg2+2 в системе. При этих условиях потенциал каломельного электрода постоянен и равен 0,241 В. В настоящее время каломельный электрод стараются не использовать из-за высокой токсичности ртути и ее солей.
Дата публикования: 2014-10-16; Прочитано: 6630 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
