 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение Нернста
|
|
Электродный потенциал возникает на границе соприкосновения металла с жидкостью, например с водой или водным раствором соли этого металла. Условное обозначение такой системы Мz+/М, где Мz+ - потенциалопределяющие катионы металла (окисленная форма), черта отмечает наличие границы раздела раствор - твердая фаза, М - металл (восстановленная форма).
Рассмотрим процессы, протекающие при погружении металла в воду. Между катионами металлической решетки на поверхности металла и диполями воды возникают силы электростатического ион-дипольного взаимодействия. Те катионы, кинетическая энергия теплового движения которых достаточно велика, вследствие гидратации отрываются от поверхности металла и переходят в воду (реакция окисления). При этом металл заряжается отрицательно за счет избытка оставшихся электронов, а вода - положительно за счет перешедших в нее катионов металла. Разумеется, процесс перехода катионов в воду сопровождается и обратным процессом - переходом дегидратированных катионов металла из полученного водного раствора на поверхность металла (реакция восстановления). В целом этот окислительно-восстановительный процесс может быть выражен уравнением:
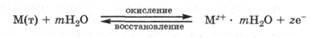
При погружении металла в чистую воду в начальный момент времени скорость выхода катионов 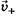 максимальна, а скорость их входа
максимальна, а скорость их входа 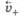 минимальна, поэтому
минимальна, поэтому 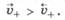 По мере протекания процесса окисления скорость выхода катионов металла уменьшается, а скорость их входа в твердую фазу увеличивается в результате возникновения ДЭС и взаимодействия с ним ионов. Через некоторое время скорости выхода и входа катионов выравниваются
По мере протекания процесса окисления скорость выхода катионов металла уменьшается, а скорость их входа в твердую фазу увеличивается в результате возникновения ДЭС и взаимодействия с ним ионов. Через некоторое время скорости выхода и входа катионов выравниваются 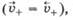 и в системе устанавливается равновесный ДЭС, в котором поверхность металла заряжена отрицательно, а раствор - положительно (рис. 25.1, а). Установившийся ДЭС характеризуется равновесным электродным потенциалом.
и в системе устанавливается равновесный ДЭС, в котором поверхность металла заряжена отрицательно, а раствор - положительно (рис. 25.1, а). Установившийся ДЭС характеризуется равновесным электродным потенциалом.
Если металл погрузить не в чистую воду, а в водный раствор его соли, то в зависимости от природы металла и концентрации (активности) его ионов в растворе возможно, что в начале скорость перехода катионов металла в раствор будет меньше, чем скорость их осаждения на поверхности металла, т. е. 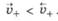 .В этом случае вследствие первоначального преимущества самопроизвольного восстановления катионов металла возникает равновесный ДЭС, в котором металл заряжен положительно, а раствор -отрицательно (рис. 25.1, б).
.В этом случае вследствие первоначального преимущества самопроизвольного восстановления катионов металла возникает равновесный ДЭС, в котором металл заряжен положительно, а раствор -отрицательно (рис. 25.1, б).
Следовательно, в результате перехода катионов металла через поверхность раздела металл - раствор всегда образуется ДЭС и возникает электродный потенциал. Величина электродного потенциала ф(Мz+/М), возникающего на границе металл -раствор, зависит от следующих факторов:
- природы металла (энергии его кристаллической решетки, энергии ионизации атомов металла и энергии гидратации его катионов);
- активности (эффективной концентрации) потенциалопределяющих ионов в растворе;
- температуры раствора.
Потенциал, возникающий в системе при стандартных условиях, называется стандартным и обозначается ф°(Мz+/М).
Стандартным электродным потенциалом называется потенциал, возникающий на границе металл - раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и температуре 298 К.
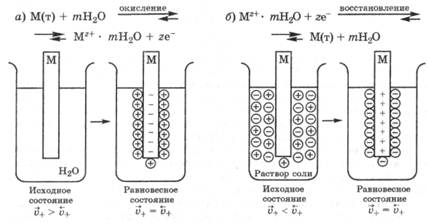
Рис. 25.1. Возникновение электродных потенциалов:
а — при погружении металла в чистую воду; б - при погружении металла в раствор его соли
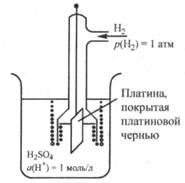 |
Рис. 25.2. Стандартный водородный электрод
Абсолютное значение стандартного электродного потенциала отдельно взятого электрода измерить или рассчитать невозможно, но можно определить его значение относительно какого-либо электрода, выбранного в качестве эталона. Согласно Международному соглашению таким эталоном служит стандартный водородный электрод.
В электрохимии используется шкала стандартных потенциалов, определенных относительно потенциала стандартного водородного электрода, значение которого условно принято равным нулю.
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью (рыхлой платиной) и опущенную в раствор кислоты, в котором активность ионов водорода равна 1 моль/л и через который все время пропускается очень чистый газообразный водород под давлением 1 атм (101 325 Па) (рис. 25.2).
Условное обозначение стандартного водородного электрода:
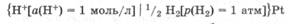
На водородном электроде протекают обратимые процессы:

Потенциал стандартного водородного электрода условно принят за нуль при любой температуре:
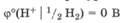
Следует отметить, что водородный электрод не очень удобен в работе, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого определяются потенциалы других электродов. На практике вместо водородного электрода в качестве электрода сравнения широко используют хлорсеребряный электрод, устройство и работа которого будут рассмотрены в разд. 25.6.
Для определения электродного потенциала какого-либо электрода относительно стандартного водородного составляют гальваническую цепь (элемент) из двух полуэлементов: исследуемого электрода и стандартного водородного электрода.
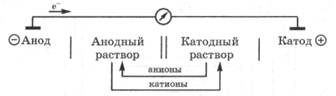
Гальваническая цепь представляет собой замкнутую систему, состоящую из двух электродов, соединенных между собой внешней цепью - электронный проводник (металл) и внутренней цепью - ионный проводник (растворы электролита, соединенные солевым мостиком). В гальванической цепи происходит превращение химической энергии процессов окисления и восстановления в электрическую энергию. В гальванической цепи различают электроды: анод и катод.
Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т. е. отдача электронов.
В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь. Анодом всегда является электрод, материал которого легче окисляется, например более активный металл. В отличие от анода, анодный раствор из-за накопления в нем избытка катионов заряжается положительно.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т. е. присоединение электронов.
В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи. Катодом является электрод из менее активного металла, катионы которого легче восстанавливаются. В отличие от катода, катодный раствор в гальванической цепи заряжается отрицательно из-за накопления в нем анионов.
Необходимо всегда помнить, что при рассмотрении электролиза (когда электрическая энергия превращается в химическую) характер процессов, протекающих на электродах, сохраняется, а знаки анода и катода изменяются на противоположные.
При условном обозначении гальванической цепи анод записывается слева, катод справа. Граница раздела между электродом и раствором, в который он опущен, обозначается одной чертой, а электролитический мостик, соединяющий анодный и катодный растворы, обозначается двумя чертами:
При замыкании гальванической цепи в ней из-за пространственного разделения реакций окисления (анод) и восстановления (катод) происходит направленное движение электронов от анода к катоду по внешней цепи, а ионов - по внутренней цепи (электролитическому мостику). Вследствие возникновения направленного движения заряженных частиц в гальванической цепи имеет место превращение химической энергии окислительно-восстановительных реакций в электрическую. Таким образом, гальванические цепи могут быть химическими источниками тока.
Способность гальванической цепи к переносу электрических зарядов характеризуется электродвижущей силой (ЭДС).
ЭДС гальванической цепи определяется как разность потенциалов катода и анода: Е = фк — фа.
В гальванической цепи, работающей самопроизвольно, потенциал анода всегда меньше потенциала катода, и ее ЭДС - величина положительная (Е > 0).
Измерение электродных потенциалов. Если измерить ЭДС гальванической цепи, составленной из исследуемого электрода и стандартного водородного, то можно определить значение электродного потенциала исследуемого электрода.
Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению и имеет знак "+", если на нем протекает процесс восстановления, и знак "-", если процесс окисления.
Рассмотрим конкретные примеры. Определим значение стандартного потенциала цинкового электрода, опущенного в раствор соли цинка, в котором активность катионов a(Zn2+) = 1 моль/л. Поскольку цинк окисляется легче, чем водород, то в гальванической цепи цинковый электрод будет анодом, а стандартный водородный электрод - катодом (рис. 25.3).
Запишем схему составленной гальванической цепи:

Рис. 25.3. Гальваническая цепь для измерения стандартного электродного потенциала цинкового электрода
ЭДС этой гальванической цепи равна разности потенциалов катода и анода:
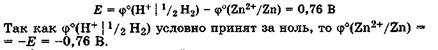
Определим стандартный потенциал медного электрода, если ЭДС гальванической цепи, составленной из определяемого электрода и стандартного водородного, равна 0,34 В.

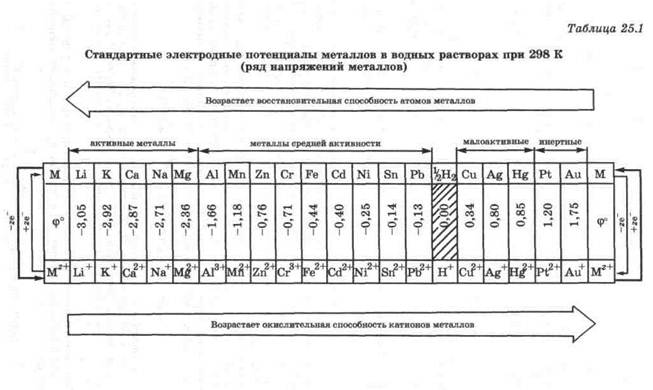
Величина стандартного электродного потенциала металла характеризует его способность отдавать электроны и имеет постоянное для каждого металла значение. Стандартные электродные потенциалы металлов приведены в табл. 25.1.
Ряд напряжений - это расположение металлов в порядке возрастания их стандартных электродных потенциалов.
В ряду напряжений те металлы, которые отдают электроны легче, чем водород, стоят слева от водорода и имеют отрицательные значения стандартных электродных потенциалов. Те металлы, которые отдают электроны труднее, чем водород, стоят справа от водорода и имеют положительные значения стандартных электродных потенциалов. Чем меньше значение ф°(Мz+/М), тем активнее металл.
Уравнение Нернста. Значение электродного потенциала, возникающего на границе металл - раствор, зависит от природы металла, активности его ионов в растворе и от температуры. Влияние всех перечисленных факторов на величину электродного потенциала металла выражается уравнением Нернста:
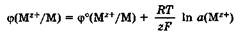
где ф° - стандартный электродный потенциал; R - универсальная газовая постоянная, 8,31 Дж/(моль • К); Т - температура, К; г - заряд потен-циалопределяющих ионов металла; F - число Фарадея, 96 500 Кл/моль; а(Мz+) - активность потенциалопределяющих ионов металла в растворе, моль/л.
Если ввести численные значения постоянных R и F и перейти от натурального логарифма к десятичному, уравнение Нернста примет вид:
 |
При стандартной температуре 298 К уравнение Нернста имеет вид:
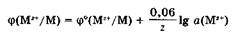
Зависимость электродного потенциала металла от концентрации его катионов в растворе лежит в основе применения концентрационных гальванических цепей.
Концентрационные гальванические цепи. В этих цепях материал электродов одинаковый, но они опущены в растворы с различной концентрацией потенциалопределяющих ионов. В концентрационных гальванических цепях анодом будет тот электрод, который опущен в раствор с меньшей концентрацией соли, а катодом - электрод, опущенный в раствор с большей концентрацией соли. ЭДС концентрационной гальванической цепи равна:

Концентрационные гальванические цепи широко используются для определения эффективной концентрации (активности) ионов в растворах, а также растворимости малорастворимых электролитов.
Дата публикования: 2014-10-16; Прочитано: 14006 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
