 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электрическая подвижность ионов в растворе
|
|
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
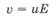
где v - скорость движения иона, м/с; Е - напряженность поля, В/м; и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В * с).
Подвижность иона характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле. Рассмотрим основные факторы, влияющие на подвижность иона в водных растворах при наличии электрического поля.
Заряд и радиус иона, т. е. его природа. Влияние этих характеристик иона взаимосвязано, но неоднозначно: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем толще его гидратная оболочка и, следовательно, тем ниже подвижность иона в растворе. В соответствии с этим в ряду однозарядных ионов Li+, Na+, К+, Rb+, Cs+, который характеризуется последовательным возрастанием ионного радиуса, радиус гидратированного иона, наоборот, уменьшается, а определенная опытным путем электрическая подвижность ионов возрастает от Li+ к Cs+:

Отсутствие резких различий в подвижности многозарядных и однозарядных ионов также объясняется большей гидратацией многозарядных ионов, что увеличивает размер и снижает их подвижность в электрическом поле несмотря на больший заряд.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем лучше сольватируется ион, тем больше размеры гидратированного иона и, следовательно, меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Поскольку подвижность ионов зависит от многих факторов, и прежде всего от их концентрации в растворе, то для характеристики свойств ионов используются значения предельной электрической подвижности ионов в данном растворителе при данной температуре, которые для водных растворов приведены в табл. 24.1.

Предельной подвижностью иона (и°, м2/(В * с)) называется средняя скорость его направленного движения, приобретаемая им в бесконечно разбавленном растворе в однородном электрическом поле напряженностью 1 В/м.
Различают предельные подвижности катионов и+ 0 и анионов и- 0, поскольку в электрическом поле эти частицы движутся в противоположных направлениях.
Предельная подвижность иона в данном растворителе зависит только от природы иона и температуры. Приведенные в таблице данные показывают, что у большинства ионов предельные подвижности очень малы: (3 - 8) * 10-8 м2/(В * с). Значительно больше подвижность ионов Н+ (Н3О+) и ОН-. Это связано с тем, что данные ионы образуются при обратимой диссоциации молекул воды, поэтому для них характерен «эстафетный» механизм перемещения. Под действием электрического поля ион гидроксония передает протон по водородной связи молекуле воды ближайшего ассоциата. В результате этот ассоциат приобретает избыточный положительный заряд, который он передает соседнему ассоциату, отдавая протон от ближайшей к нему молекулы воды вдоль силовых линий электрического поля:
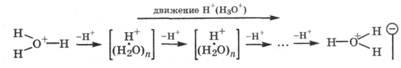
Таким образом, за счет перескока протона от ассоциата к ассоциату по водородной связи происходит быстрое перемещение иона гидрок-сония к отрицательному полюсу.
Аналогично происходит перемещение иона гидроксила в водной среде к положительному полюсу путем отщепления им протона от молекулы воды ближайшего ассоциата. Однако подвижность иона гидроксила меньше, чем иона Н30+, так как протон в ионе Н30+ связан менее прочно, чем в молекуле воды. В неводных растворителях, где невозможен "эстафетный" механизм движения, ионы Н+ и ОН- не имеют аномально большой скорости движения.
Дата публикования: 2014-10-16; Прочитано: 22719 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
