 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электронные состояния атома азота в его соединениях и свойства этих соединений
|
|
Главная особенность атома азота в соединениях связана со способностью выступать донором неподеденной пары электронов.
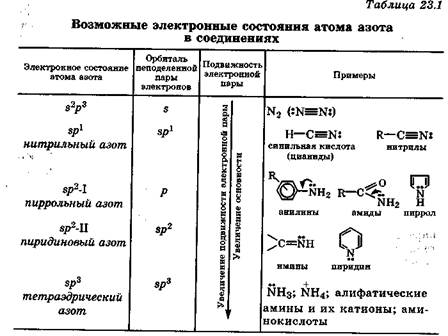
Донорная способность резко изменяется в зависимости от характера атомной орбитали, которую занимает неподеленная электронная пара, т. е. определяется электронным состоянием атома азота. Для атома азота может быть реализовано пять различных электронных состояний (рис. 23.1).
Основное (невозбужденное) электронное состояние 2s22p3 реализуется в молекуле азота  , где тройная связь образована за счет трех неспаренных 2р-электронов каждого из атомов азота. В этом случае неподеленная электронная пара каждого атома азота находится на 2s-орбитали. Подвижность этих пар и п- электронов кратной связи мала, поэтому молекулярный азот химически инертен (разд. 12.2.3).
, где тройная связь образована за счет трех неспаренных 2р-электронов каждого из атомов азота. В этом случае неподеленная электронная пара каждого атома азота находится на 2s-орбитали. Подвижность этих пар и п- электронов кратной связи мала, поэтому молекулярный азот химически инертен (разд. 12.2.3).
Другие электронные состояния атома азота в соединениях описываются с помощью гибридизации его атомных орбиталей:
—электронное состояние sp3, когда все четыре внешние атомные орбитали гибридизуются по s р3-типу, образуя четыре равноценные орбитали, на одной из которых находится неподеленная пара электронов;
—электронное состояние sp2-I, когда на трех гибридных ор-биталях находятся три неспаренных электрона, а неподеленная электронная пара занимает чистую р-орбиталь;
—электронное состояние sp2-II, когда неподеленная электронная пара занимает одну из sр2-гибридных орбиталей, а чистую р-орбиталь занимает неспаренный электрон, за счет которого атом азота образует π-связь;
—электронное состояние sp1, когда неподеленная электронная пара занимает одну их двух sp-гибридных орбиталей, а остальные орбитали занимают неспаренные электроны, за счет которых атом азота образует одну  - и две π -связи.
- и две π -связи.
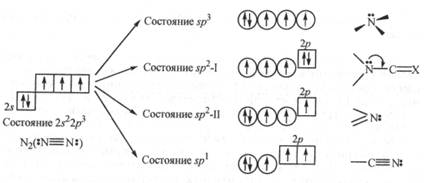
Рис. 23.1. Электронные состояния атома азота в его соединениях
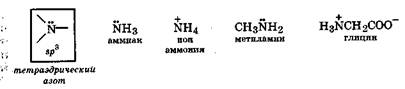
В электронном состоянии sp3 неподеленная пара электронов атома азота находится на гибридной sрЗ-орбитали, поэтому ее подвижность велика. Это позволяет атому азота, при наличии соответствующего партнера, активно образовывать еще одну (четвертую) связь по донорно-акцепторному механизму. Такие свойства характерны для атома азота в аммиаке, алифатических аминах и их производных - а-аминокислотах. Эти соединения легко образуют соли, т. е. аммонийные производные. Атом азота в электронном состоянии sp3 называется тетраэдрическим азотом.
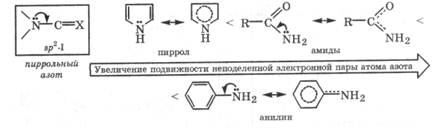
В электронном состоянии sp2-I неподеленная пара электронов атомов азота находится на чистой р-орбитали. Это позволяет ей активно участвовать в сопряжении с π-электронами соседних кратных связей, что приводит к эффективной делокализации электронной плотности в сопряженной системе. Вовлечение неподеленной пары электронов в сопряженную систему, отражаемое с помощью изогнутой стрелки, сильно снижает ее подвижность. При этом резко уменьшается способность атома азота выступать донором электронной пары в донорно-акцепторных взаимодействиях. Электронное состояние sp2-I энергетически наиболее выгодно. Оно характерно для атома азота в анилине, амидах и пирроле. Такой атом азота в соединениях часто называют пиррольным азотом.
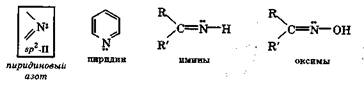
В электронном состоянии sp2-II неподеленная пара электронов атома азота находится на гибридной sр2-орби-тали и по стерическим причинам не может участвовать в сопряжении, так как лежит в плоскости  -связей. В состоянии sp2-II атом азота сохраняет способность быть донором электронной пары, хотя и в меньшей степени, чем в состоянии sp3. Это вызвано снижением подвижности неподеленной электронной пары из-за большего приближения к ядру атома азота и усиления взаимодействия с ним. Энергетически такое состояние атома азота наи менее выгодно. Оно характерно для атома азота, образующего двойную связь, например в пиридине, иминах, оксимах. В этих случаях часто используют термин пиридиновый азот.
-связей. В состоянии sp2-II атом азота сохраняет способность быть донором электронной пары, хотя и в меньшей степени, чем в состоянии sp3. Это вызвано снижением подвижности неподеленной электронной пары из-за большего приближения к ядру атома азота и усиления взаимодействия с ним. Энергетически такое состояние атома азота наи менее выгодно. Оно характерно для атома азота, образующего двойную связь, например в пиридине, иминах, оксимах. В этих случаях часто используют термин пиридиновый азот.
В электронном состоянии sp1 неподеленная электронная пара атома азота находится на sp1-гибридной атомной орбитали. Из-за сильного взаимодействия с ядром подвижность неподеденной пары атома азота в этом случае крайне низкая. Поэтому нитрилы, где реализуется это состояние, очень слабые основания (рКа(ВН+) = -10). В то же время нитрилы чрезвычайно склонны к образованию комплексных соединений, но за счет подвижности π-электронов тройной связи (разд. 10.4). Среди природных соединений нитрилы встречаются очень редко.
Таким образом, лабильность атома азота и его специфичность как органогена проявляются прежде всего в способности изменять свои электронодонорные свойства путем изменения электронного состояния (табл. 23.1).
 |
Рассмотренные особенности состояния неподеленной пары электронов атома азота сильно влияют на свойства природных азотсодержащих соединений, включая гетероциклические. В молекулах таких соединений часто содержатся одновременно несколько атомов азота, неподеленные пары электронов которых находятся на атомных орбиталях разного типа, что делает эти атомы азота резко различными по свойствам. Это наблюдается в гуанидиновом и имидазольном фрагментах природных а-амино-кислот или
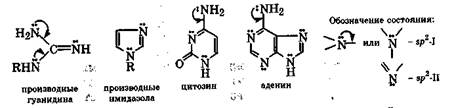 |
белков, а также в цитозине, аденине и гуанидине -структурных единицах нуклеиновых кислот.
Специфическая особенностьэлектронных состояний атома азота отражается на основных, комплексообразующих, нуклео-фильных и кислотных свойствах азотсодержащих соединений. Первые три свойства определяются прежде всего подвижностью неподеленной пары электронов атома азота в этих соединениях и склонностью ее к взаимодействию с определенным партнером.
Основность - это сродство к протону.
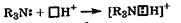
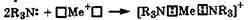 |
Комплексообразование - сродство к катиону комплексообразователя.
Нуклеофилъностъ - сродство к карбкатиону, точнее - к атому углерода, несущему в соединении частичный положительный заряд.
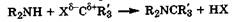
В случае азотсодержащих природных соединений все три свойства изменяются симбатно с увеличением подвижности неподеленной пары электронов атома азота:
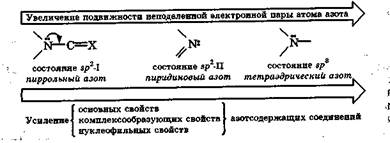
Эта последовательность удобна для сравнительной оценки перечисленных свойств разных атомов азота в биосубстратах.
Основные свойства. Вследствие наличия у атома азота непо-деленной пары электронов азотсодержащие соединения способны образовывать ковалентную связь по донорно-акцепторному механизму с катионом водорода, проявляя основные свойства.
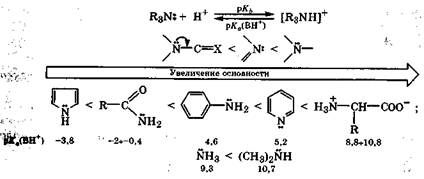
Сила азотсодержащих оснований тем больше, чем подвижнее неподеленная электронная пара атома азота. Наиболее сильными основаниями будут соединения, содержащие атом азота, у которого неподеленная пара электронов находится на гибридной sp3- орбитали, а наиболее слабыми основаниями - соединения, в которых атом азота содержит неподеленную пару электронов на чистой р-орбитали, участвующей в p, π-сопряжении. Таким образом, наиболее сильными основаниями являются алифатические амины, аммиак и природные а-аминокислоты; очень слабыми основаниями - амиды, и особенно пиррол, в молекуле которого неподеленная электронная пара атома азота активно участвует в образовании сопряженной ароматической системы из шести электронов. Количественно основность азотсодержащих оснований в водной среде отражается величиной рKа(ВН+), характеризующей кислотность сопряженной кислоты данного основания (разд. 8.1; табл. 8.1):
Кроме того, сила азотсодержащего основания особенно возрастает, если его катион стабилизируется за счет сопряжения. По этой причине гуанидин (иминомочевина) является очень сильным основанием (рКа(ВH+) = 13,5):
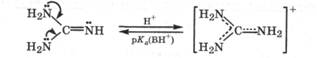
Таким образом, значение характеристики основности атома азота в соединениях в зависимости от его электронного состояния, природы заместителя и устойчивости катиона этого соединения может отличаться более чем на семнадцать порядков, т. е. в 1017 раз.
Кислотные свойства. Вследствие полярности связи N—Н (м = 1,31 Д) азотсодержащие соединения проявляют кислотные свойства за счет диссоциации этой связи (NH-кислоты). Наиболее это характерно для соединений, в которых неподеленная пара электронов атома азота участвует в р,π-сопряжении (—NH—С==Х), а образующийся анион стабилизируется наличием развитой сопряженной системы.
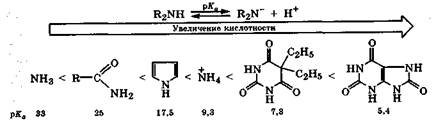
Кислотные свойства азотсодержащих оснований нуклеиновых кислот будут рассмотрены в разд. 23.3.
Таким образом, NH-кислотность азотсодержащих соединений варьирует в очень широких пределах и зависит от электронного состояния атома азота, природы заместителя и стабильности образуемого аниона.
Комплексообразующие свойства. Наличие у атома азота подвижной неподеленной пары электронов делает азотсодержащие соединения легкополяризуемыми лигандами, которые образуют прочные комплексы с природными комплексообразователями Cu2+, Zn2+, Ni2+ (разд. 10.3). Особенно активны в реакциях ком-плексообразования азотсодержащие соединения, имеющие несколько атомов азота, неподеленные пары электронов которых сильно подвижны и стерически доступны, например этилен-диамин (H2N—СН2—СН2—NH2) или другие полиметилен-диамины (H2N— (СН2)n—NH2, п = 3 -6). Такие ди- или полидентатные лиганды образуют очень устойчивые комплексы-хелаты (разд. 10.3).
Подвижность неподеленной пары электронов у атомов азота резко возрастает, если процессу комплексообразования предшествует отщепление катиона водорода от связи N—Н, как это имеет место при образовании комплексов с аминокислотами или порфиринсодержащих комплексов: гемоглобина, цитохромов, хлорофилла (гл. 10):
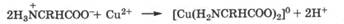
Таким образом, наиболее активные лиганды - это азотсодержащие соединения, в которых неподеленная пара электронов атома азота находится на sp3-гибридной орбитали или чистой р-орбитали (пиридиновый азот) и которые способны образовывать хелатные комплексы. Это характерно для многих биосубстратов: аминокислот, белков, нуклеиновых кислот.
Нуклеофильные свойства. Природные азотсодержащие соединения проявляют нуклеофильные свойства в реакциях алкилирования или ацилирования по атому азота.
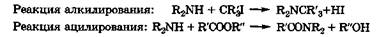
В условиях организма эти реакции протекают в водной среде под действием ферментов алкил- или ацилтрансфераз, каждый из которых активен только по отношению к определенному субстрату. Единой количественной характеристики нуклеофильности соединений в настоящее время нет. Однако для качественной оценки нуклеофильности того или иного атома азота в биосубстрате можно использовать данные по его основности, так как обычно эти свойства изменяются для азотсодержащих соединений симбатно.
Окислительно-восстановительные свойства. В природных азотсодержащих соединениях атом азота имеет степень окисления -3, поэтому он может выступать только восстановителем, т. е. отдавать электроны. Подобная реакция протекает в нитрифицирующих бактериях, которые окисляют аммиак кислородом в нитраты при участии фермента нитрогеноксидазы и АТФ:
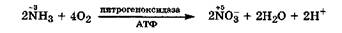
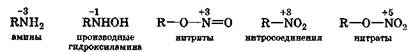 |
В высших организмах эта реакция не протекает из-за отсутствия данного фермента, а при окислении кислородом азотсодержащих органических соединений окисляются их атомы углерода, так как они более сильные восстановители, чем атомы азота.
В органических азотсодержащих соединениях атом азота может иметь степени окисленияот -3 до +5:
Специально синтезируемые органические соединения, молекулы которых содержат несколько нитро- или нитратных групп, проявляют взрывчатые свойства. Реакции их разложения относятся к реакциям внутримолекулярного окисления-восстановления и сопровождаются большим выделением энергии. Окислителями в них выступают атомы азота нитро- и нитратных групп со степенью окисления +3 или +5 соответственно, которые превращаются в молекулярный азот, а восстановителями являются прежде всего атомы углерода, но когда их мало, то и атомы кислорода:
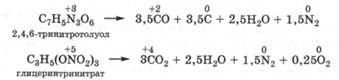
Многие органические нитраты: глицеринтринитрат, пента-эритриттетранитрат (нитропентон), сорбитдинитрат (изодинит) -широко применяются как сердечно-сосудистые средства. Их действие главным образом заключается в расслаблении гладкой мускулатуры периферических сосудов и их расширении. Поэтому их применяют для профилактики ишемической болезни сердца и снятия приступов стенокардии.
Таким образом, атомы азота в природных веществах могут быть только восстановителями, но этих свойств в большинстве организмов они не проявляют. В соединениях, содержащих атомы азота в степенях окисления +3 - +5, они могут выступать окислителями. Если же степень окисления атомов азота в соединениях промежуточная (от -2 до +3), то они могут проявлять окислительно-восстановительную двойственность.
Рассмотрев свойства атомов азота в природных соединениях, следует подчеркнуть, что в них этот органоген имеет степень окисления -3 и выступает в основном донором своей неподеленной электронной пары, обеспечивая биосубстратам свойства основания, лиганда и нуклеофила. Кроме того, вследствие полярности связи N - Н азотсодержащие соединения могут проявлять свойства NH-кислот.
Дата публикования: 2014-10-16; Прочитано: 6293 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
