 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Азотсодержащие ароматические гетероциклические соединения
|
|
Гетероциклическими называют органические соединения, в состав цикла которых помимо атомов углерода входят один или несколько атомов других элементов — гетероатомов. Наиболее важное значение имеют гетероциклы, содержащие атомы N, О и S. Включение этих гетероатомов вместо групп —СН=СН—, —СН= или —СН2- в циклическую систему не очень сильно изменяет общую геометрию молекулы и мало влияет на напряжение в цикле. Особый интерес вызывает обширная группа гетероциклов, имеющих циклические сопряженные системы кратных связей, в которых может принимать участие неподеленная электронная пара гетероатома, находящаяся на р-орбитали. Такого рода гетероциклы напоминают своей устойчивостью бензол и получили название ароматические гетероциклы. Именно эти соединения, содержащие в цикле один или несколько атомов азота, и будут объектом нашего рассмотрения.
Пятичленные гетероциклы. Пятичленные гетероциклические соединения можно рассматривать как продукт замещения в бензольном цикле одной группировки —СН=СН— на гетеро-атом с неподеденной парой электронов. Внимание будет уделено пирролу, индолу и имидазолу, поскольку эти азотсодержащие соединения или их производные составляют основу многих природных биологически активных веществ и лекарственных средств.
Пиррол. Молекула пиррола содержит систему сопряженных связей, включая неподеленную пару электронов атома азота:
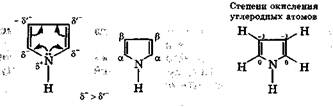
Четыре атома углерода молекулы пиррола находятся в sp2-  - стоянии, а атом азота — в sp2-I состоянии, соответственно все
- стоянии, а атом азота — в sp2-I состоянии, соответственно все  -связи между ними расположены в одной плоскости. Неподеленная электронная пара атома азота находится на p-орбитали и участвует в сопряжении с π-электронами соседних двойных связей. Энергия делокализации электронов в π-системе пиррола составляет 110 кДж/моль, следовательно, он имеет ароматический характер. Атом азота является донором электронной пары для π-системы, поэтому на углеродных атомах цикла плотность π-электронов увеличена, причем в а-положении больше, чем в B-положении. Это делает пиррол электроноизбыточным гетероциклом, благодаря чему он легче вступает в реакции электрофильного замещения по сравнению с бензолом и легко окисляется.
-связи между ними расположены в одной плоскости. Неподеленная электронная пара атома азота находится на p-орбитали и участвует в сопряжении с π-электронами соседних двойных связей. Энергия делокализации электронов в π-системе пиррола составляет 110 кДж/моль, следовательно, он имеет ароматический характер. Атом азота является донором электронной пары для π-системы, поэтому на углеродных атомах цикла плотность π-электронов увеличена, причем в а-положении больше, чем в B-положении. Это делает пиррол электроноизбыточным гетероциклом, благодаря чему он легче вступает в реакции электрофильного замещения по сравнению с бензолом и легко окисляется.
Пиррол - бесцветная жидкость (т. кип. 131 °С) с запахом хлороформа, практически нерастворимая в воде и быстро темнеющая на воздухе из-за окисления. Молекула пиррола содержит полярную связь N—Н и является очень слабой NH-кислотой (рКа = 17,5). При взаимодействии со щелочными металлами пиррол образует соли, устойчивые в отсутствие воды:

Поскольку неподеленная электронная пара атома азота де-локализована, то пиррол является очень слабым основанием. В сильнокислой среде ароматическая система пиррола нарушается вследствие протонирования, и он легко полимеризуется с образованием темной смолы. Поэтому пиррол называют ацидофобным, т. е. не выдерживающим присутствия кислот.
Реакции электрофильного замещения в пирроле обычно проводят в щелочной среде. Даже такой слабый электрофил, как I2, в этих условиях замещает четыре водородных атома пиррола, образуя тетраиодпиррол:
 )
)
Реакция сопровождается окислением углеродных атомов пиррола и восстановлением атомов иода.
Наиболее реакционноспособно к электрофильному замещению в пирроле а-положение. Так, конденсацией пиррола с муравьиной кислотой можно получить порфин:
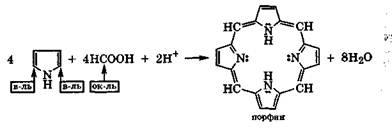
Эта конденсация, естественно, тоже сопровождается окислением а-углеродных атомов пиррола и восстановлением углеродных атомов муравьиной кислоты.
Плоский макроцикл порфина является ароматической сопряженной системой, π-электронное облако которой содержит 26 электронов (22 электрона одиннадцати двойных связей и две неподеленные электронные пары двух атомов азота). Это соответствует правилу ароматичности 4n+2, где n= 6. Порфины, частично или полностью замещенные в пиррольных циклах, называются порфиринами. Это активные хелатообразующие четырехдентатные лиганды, входящие в состав важных природных комплексных соединений: гемоглобина, цитохромов, хлорофилла (разд. 10.4).
При биологическом окислении в печени гемоглобина и других порфиринсодержащих метаболитов образуются билирубиноиды, содержащие линейную тетрапиррольную систему. Наиболее важный из них - билирубин имеет оранжевую окраску.

Эти вещества являются пигментами желчи, часть которых выделяется с мочой, сообщая ей характерный желтый оттенок. Они же вызывают пожелтение кожи при желтухе, что свидетельствует о чрезмерном разрушении порфинсодержащих метаболитов в печени. При гидрировании пиррола происходит постепенное присоединение водорода по кратным связям:

 |
При этом ароматическая система пиррола разрушается и атом азота переходит в sр3-состояние. В результате основность полученных соединений намного выше, чем основность пиррола (pKa(BH+) = -3,8). Так, для пирролидина р.Ка(ВН+) =11,3. Пирролидиновое кольцо входит в состав a-аминокислот (пролин, гидроксипролин), а также алкалоидов (никотин):
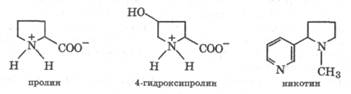
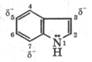
Индол (бензопиррол) является конденсированным гетероциклическим соединением, состоящим из бензольного и пиррольного ядра. Индол имеет циклическую сопряженную систему, содержащую 10 электронов. В индоле электронодонорное действие атома азота проявляется в повышении электронной плотности на углеродных атомах, особенно в положениях 3, 5 и 7. В отличие от пиррола, в индоле электрофильные реагенты прежде всего атакуют углеродный атом в положении 3, что обусловлено влиянием бензольного цикла. Индол, подобно пирролу, практически не обладает основными свойствами, ацидофобен, ведет себя как слабая NH-кислота (рКа = 17), легко окисляется, из-за чего быстро темнеет на воздухе.
Среди биологически активных производных индола прежде всего следует отметить a-аминокислоту - триптофан. В организме триптофан гидроксилируется в 5-гидрокситриптофан, который в результате декарбоксилирования превращается в серотонин. Серотонин играет исключительно важную роль в обмене веществ у высших млекопитающих, регулируя передачу импульсов в нервных тканях и кровяное давление.
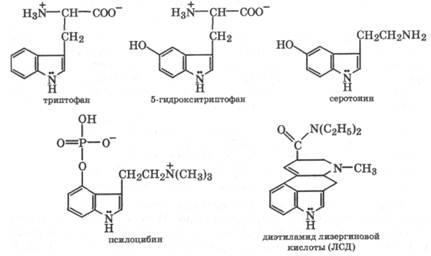
Производными индола являются наиболее сильные галлюциногены: псилоцибин и диэтиламид лизергиновой кислоты (ЛСД). Последний - наиболее сильнодействующий наркотик, его действующая доза около 10-3 мг. Эти галлюциногены - антагонисты серотонина, поэтому их применение нарушает концентрацию се-ротонина в мозге, что приводит к отклонению от нормального психического состояния.
 |
Имидазол. Замена в пирроле группы =СН— в Р-положении на атом азота
 с неподеленной электронной парой на sp2-орбитали приводит к ароматическому гетероциклу - имидазолу. Атом азота в положении 1 ана логичен атому азота в пирроле. Его полярная связь N—Н обеспечивает имидазолу слабые кислотные свойства (рКа = 14,2).
с неподеленной электронной парой на sp2-орбитали приводит к ароматическому гетероциклу - имидазолу. Атом азота в положении 1 ана логичен атому азота в пирроле. Его полярная связь N—Н обеспечивает имидазолу слабые кислотные свойства (рКа = 14,2).

Атом азота в положении 3 находится в sp2-II состоянии, поэтому его неподеленная электронная пара участвует в сопряжении и обеспечивает гетероциклу основные свойства (рКа(ВH+) = 6,95).
Таким образом, имидазол - амфолит из-за наличия в молекуле и кислотного, и основного центров, поэтому у него имеются прекрасные возможности для межмолекулярной ассоциации за счет водородных связей:
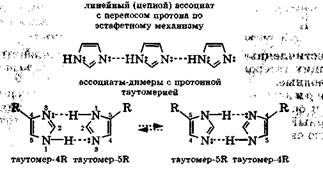
Следствием подобной ассоциации является быстрый межмолекулярный обмен протонами, который приводит в случае линейных ассоциатов к переносу протона по эстафетному механизму, а в случае димеров — к прототропной таутомерии. Прототропная таутомерия между димерами имидазола приводит к тому, что его производные, имеющие одинаковые заместители в разных положениях 4 и 5, неразличимы, поскольку они являются быстровзаимопревращающимися (менее 0,1 с) таутомерами, т. е. фактически одним и тем же веществом.
Имидазол и его производные, являясь, подобно молекуле воды, одновременно и донорами и акцепторами протонов, обладают исключительной способностью катализировать электрофильно-нуклеофильные реакции. Это обусловлено их способностью одновременно и согласованно воздействовать на электрофильные и нуклеофильные центры взаимодействующих соединений. Такое свойство имидазола играет важную роль в механизме действия гидролитических ферментов, способствующих гидролизу сложных эфиров, амидов и пептидов.
Высокая поляризуемость имидазола и его производных и повышенная нуклеофильность атома N-3 делают эти соединения активными лигандами по отношению к катионам d-металлов. Поэтому во многих металлопротеидах связь белка с катионом металла осуществляется через атом N-3 имидазольного заместителя а-аминокислоты гистидина.
Гистидин является одной из природных незаменимых а-ами-нокислот, содержащей имидазольный заместитель. Белки, содержащие гистидин, благодаря имидазольному заместителю способны: поддерживать нейтральную среду рН = 7 биологических систем, выступать катализаторами электрофильно-нуклеофильных реакций и образовывать достаточно прочные комплексы-металло-протеиды. При декарбоксилировании гистидина образуется гистамин, играющий важную роль в стимуляции сокращения
мускулатуры кишечника, спастических сокращений бронхов, а также в развитии аллергических и иммунных реакций:

Шестичленные гетероциклы. Среди шестичленных азотсодержащих гетероциклов рассмотрим пиридин, пиримидин и их производные.
Пиридин - бесцветная жидкость, хорошо смешивается с водой и органическими растворителями, имеет неприятный характерный запах. Пиридин токсичен, поражает центральную нервную систему.
 |
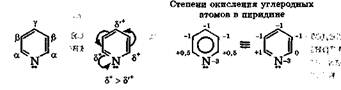
Пиридин является ароматическим соединением. Атомы углерода пиридинового кольца находятся в sp2-гибридном состоянии, а атом азота - в состоянии sp2-II. В образовании циклической
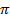 -сопряженной системы участвуют шесть p-электронов (по одному от каждого атома цикла, включая гетероатом). Поскольку электроотрицательность атома азота по сравнению с углеродом больше, то азот стягивает к себе
-сопряженной системы участвуют шесть p-электронов (по одному от каждого атома цикла, включая гетероатом). Поскольку электроотрицательность атома азота по сравнению с углеродом больше, то азот стягивает к себе 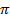 -электронное облако, понижая электронную плотность ароматического кольца. Из-за этого пиридин является электронодефицитным соединением и труднее, чем бензол, вступает в реакции электрофильного замещения. В пиридине электронная плотность неравномерно распределена по атомам углерода, что подтверждается расчетными и экспериментальными (спектральными) данными. Степени окисления его а-углеродных атомов выше, чем у других углеродных атомов кольца.
-электронное облако, понижая электронную плотность ароматического кольца. Из-за этого пиридин является электронодефицитным соединением и труднее, чем бензол, вступает в реакции электрофильного замещения. В пиридине электронная плотность неравномерно распределена по атомам углерода, что подтверждается расчетными и экспериментальными (спектральными) данными. Степени окисления его а-углеродных атомов выше, чем у других углеродных атомов кольца.В отличие от пиррола, у пиридина неподеленная пара электронов атома азота не участвует в образовании ароматического секстета. Благодаря наличию свободной электронной пары у атома азота пиридин и его производные являются основаниями. С кислотами они образуют соли пиридиния. Основность пиридина (pKa(BH+) = 5,23) несколько больше, чем у анилина (p Ka (BH+) = = 4,60), но значительно меньше основности алифатических аминов (pKa(BH+) =10).
Распределение электронной плотности в пиридине определяет ориентацию электрофильного замещения в (3-положение, а нук леофильного - в а- и у-положения. Электрофильное замещение у производных пиридина протекает с большим трудом, так как оно обычно проводится в кислой среде, где пиридин существует в виде катиона. Положительный заряд на атоме азота еще больше понижает электронную плотность в ядре и затрудняет атаку ядра электрофильной частицей:

В реакции нуклеофильного замещения по a-углеродному атому пиридин вступает легче:
 |
Рассмотренные реакции замещения являются одновременно реакциями межмолекулярного окисления-восстановления.
Каталитическое гидрирование пиридина водородом протекает постепенно и трудно, а приводит в итоге к пиперидину:

Реакция сопровождается восстановлением атомов углерода кольца, а также переходом всех его атомов, включая атом азота, в электронное состояние sp3. Поэтому основность азота возрастает: рKа(ВН+) =11,0.
Атом азота в пиридине является нуклеофилом и способен алкилироваться с образованием четвертичных алкилпиридиниевых солей:
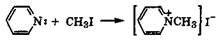
При этом электронодефицитность пиридиниевого ядра повышается из-за появления положительного заряда на атоме азота.
Производные пиридина. Многие природные соединения: витамины, коферменты, алкалоиды и большое число лекарственных препаратов - являются производными пиридина.
Никотин - бесцветное масло с табачным запахом, его содержание в листьях табака доходит до 8 %. Соединение очень ядовито, летальная доза для человека - 40 мг. Воздействует на вегетативную нервную систему и сужает кровеносные сосуды. Не исключено, что это является следствием изменения состояния воды внутри клеток соответствующих тканей из-за проникновения в них никотина - гидрофобного соединения (разд. 11.3 и 11.4).
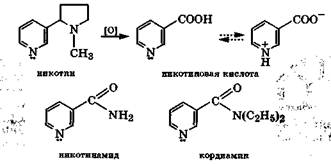
Одним из продуктов окисления никотина в жестких условиях является никотиновая кислота (Р-пиридинкарбоновая кислота), которая имеет амфотерные свойства: рКа(СООН) = 2,07, рKа(ВН+) = 4,73. Подобно а-аминокислотам она в кристаллическом состоянии и отчасти в растворах существует в виде таутомера с биполярно-ионной структурой. Никотиновая кислота - провитамин, поскольку ее амид - никотинамид - является витамином PP. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой. Диэтиламид никотиновой кислоты - кордиамин используется как эффективный стимулятор центральной нервной системы.
Никотинамиднуклеотиды. Важными представителями этой группы соединений являются коферменты никотин-амидадениндинуклеотид (НАД+) и его фосфат (НАДФ+):

В молекулах этих коферментов из-за наличия положительно заряженного атома азота и электроноакцепторной амидной группировки электронодефицитность пиридинового ядра возрастает настолько, что они способны проявлять окислительные свойства. Поэтому эти коферменты в комплексе с ферментами участвуют в окислительно-восстановительных реакциях (разд. 9.3.3) в виде окисленных форм НАД+ и НАДФ+, содержащих никотинамидный остаток в виде пиридиниевого катиона, и восстановленных форм НАД(Н) и НАДФ(Н), где указанный фрагмент, приняв два электрона и протон, превратился в 1,4-дигидропиридиновую группировку:
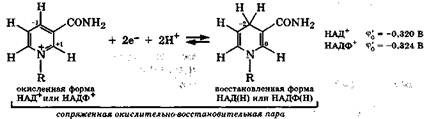
Все окислительно-восстановительные превращения биосубстратов под действием никотинамиднуклеотидов являются реакциями межмолекулярной дисмутации за счет углеродных атомов участников реакции. При переходе окисленной формы коферментов в восстановленную происходит накопление энергии, выделяемой при окислении субстрата. Накопленная восстановленной формой энергия затем расходуется в других эндэргонических процессах с участием этих коферментов (разд. 9.3.3).
Пиридоксальфосфат и витамин В6. В пиридоксаль-фосфате за счет электронодефицитности пиридинового кольца у углеродного атома альдегидной группы повышается склонность к окислительно-восстановительным превращениям. Поэтому это соединение является коферментом окислительно-восстановительных реакций трансаминирования a-кетокислот а-аминокислотами и в реакциях декарбоксилирования ряда аминокислот (разд. 21.2.5).
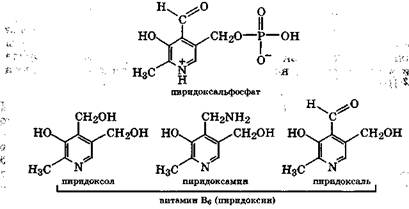
Сочетание трех индивидуальных веществ: пиридоксола, пиридоксамина и пиридоксаля - рассматривают как витамин B6 (пиридоксин), так как в организме они все способны перейти в пиридоксальфосфат, участвующий в химических реакциях, связанных с деятельностью данного витамина. Отсутствие в пище витамина B6 сопровождается резким нарушением обмена белков и липидов, что ведет к развитию атеросклероза, различных дерматитов и нарушению кроветворения.
Пиримидин и его производные. Пиримидин содержит два атома азота в положениях 1 и 3 шестичленного цикла, имеющего ароматическую шестиэлектронную  -систему. В связи с тем, что оба атома азота находятся в sp2-II состоянии и их неподеленные электронные пары не участвуют в образовании ароматической системы, пиримидин проявляет свойства слабого основания (pКа(ВH+) = 1,3):
-систему. В связи с тем, что оба атома азота находятся в sp2-II состоянии и их неподеленные электронные пары не участвуют в образовании ароматической системы, пиримидин проявляет свойства слабого основания (pКа(ВH+) = 1,3):

Основность пиримидина резко понижена по сравнению с пиридином (р Ка (ВН+) = 5,2) из-за электроноакцепторных свойств второго атома азота, находящегося в ядре. Протонизация одного атома азота настолько понижает основность другого атома азота, что дальнейшее солеобразование в естественных условиях не происходит.
Большое значение в химии нуклеиновых кислот имеют следующие оксо- и аминопроизводные пиримидина: урацил, тимин и цитозин.

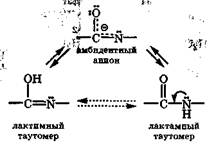 |
Для этих соединений теоретически возможна прототропная лактим-лактамная таутомерия. Соответствующие таутомеры различаются не только положением протона (у атома кислорода или у атома азота), но и электронным состоянием атома азота (sp2-II или sp2-I):
У таутомеров имеется общий амбидентный анион, отрицательный заряд которого делокализован между атомами, участвующими в таутомерии. Последнее обстоятельство объясняет двойственную реакционную способность рассмотренных соединений, т. е.
образовывать и О- и N-производные. Исследования кислотно-основных свойств и спектральных характеристик указанных оксопиримидинов и родственных им соединений свидетельствуют, что и в кристаллах, и в растворах для них характерна только лактамная форма, а их ионы амбидентны.
Урацил и тимин в естественных условиях являются слабыми двухосновными кислотами, причем их моноанионы существуют в виде двух таутомеров, различающихся положением оставшегося протона у атомов азота N-1 или N-3 и распределением делокализованного отрицательного заряда:

Таким образом, в биологических средах с рН<7,5 урацил и тимин существуют в молекулярной форме.
Цитозин - амфолит: он протонируется по атому N-1, имеющему свободную от участия в сопряжении электронную пару, а за счет депротонирования атома N-3 проявляет слабые кислотные свойства:
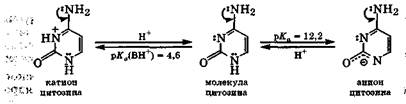
В биологических средах с рН = 3 - 6 цитозин существует в виде смеси катионов и молекул, а при рН = 7 - в молекулярной форме.
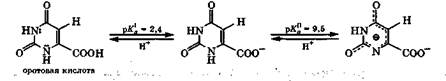 |
Среди природных оксипиримидинов важную роль играют оротовая и барбитуровая кислоты. Оротовая кислота (урацил-6-карбоновая кислота) является метаболитом, участвующим в превращении аспарагиновой кислоты в пиримидиновые производные. В условиях организма это довольно сильная двухосновная кислота:
Оротат калия - стимулятор обменных процессов в организме.
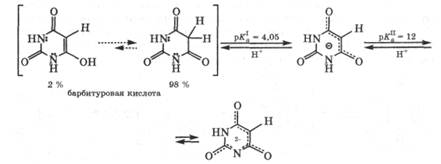
Для барбитуровой кислоты характерна кето-енольная таутомерия с преобладанием кетотаутомера (= 98 %). Барбитуровая кислота - достаточно сильная СН-кислота. Лактимная форма для этой кислоты не обнаружена.
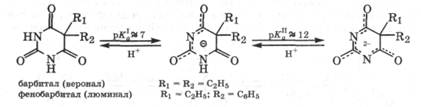
В медицине в качестве снотворных и противосудорожных средств применяют 5,5-дизамещенные барбитуровые кислоты: бар-битал и фенобарбитал, называемые барбитуратами. Они существуют только в лактамной форме и являются слабыми NH-кислотами:
 |
Пурин и его производные. Пурин - ароматическое бициклическое гетероциклическое соединение, содержащее ядро пиримидина и имидазола. Его ароматическая
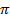 -система включает 8
-система включает 8 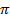 -электронов двойных связей и неподеленную электронную пару одного из атомов азота имидазольного фрагмента. Пурин, подобно имидазолу, является прототропной таутомерной системой за счет миграции протона между атомами азота N-7 и N-9. Пурин - амфолит, так как проявляет и основные (рКа(ВН+) = 2,4), и кислотные свойства (рКа = 9,9):
-электронов двойных связей и неподеленную электронную пару одного из атомов азота имидазольного фрагмента. Пурин, подобно имидазолу, является прототропной таутомерной системой за счет миграции протона между атомами азота N-7 и N-9. Пурин - амфолит, так как проявляет и основные (рКа(ВН+) = 2,4), и кислотные свойства (рКа = 9,9):
Оксо- и аминопроизводные пурина — аденин и гуанин входят в состав нуклеиновых кислот. В молекуле аденина у трех атомов азота N-l, N-3 и N-7 неподеленные электронные пары не участвуют в сопряжении, находясь на sp2-орбиталях, у двух других атомов азота неподеленные электронные пары, находясь на р-орбиталях, активно участвуют в сопряжении. Для аденина, как и для пурина, наблюдается прототропная таутомерия за счет миграции протона между N-7 и N-9. Обычно аденин изображают с протоном у атома N-9, хотя в его водных растворах содержание таутомера N7H в 2,5 раза выше. Аденин является амфо-литом, способным, в зависимости от кислотности среды, или присоединять протон к пиримидиновому атому азота, образуя катион, или отщеплять протон от имидазольного атома азота с образованием аниона:

В биологических средах с рН =7 аденин находится в основном в виде молекул, а в кислых средах (рН = 3 - 6) - в виде смеси молекул и катионов. Аденин входит в состав некоторых ко-ферментов, аденозинтрифосфорной кислоты (АТФ) и ее производных АДФ и АМФ.
 |
Для гуанина характерна лактамная форма, поэтому неподеленная электронная пара атома N-1 находится на р-орбитали и активно участвует в сопряжении. В соответствии с -кислотно-основными свойствами гуанин, в зависимости от рН-среды, в водных растворах может находиться в форме катиона, молекулы, моно- или дианиона:
В биологических средах с рН = 3 - 6 гуанин находится в виде смеси молекул и катионов, а при рН = 7 - 9 — молекул и моноанионов. Таким образом, из всех азотистых оснований нуклеиновых кислот наиболее сильные основные свойства проявляет аденин.
В условиях организма цитозин и гуанин — слабые основания, а урацил и тимин - слабые кислоты. Для всех этих гетероциклических соединений характерно образование водородных связей, при котором они выступают одновременно и как доноры, и как акцепторы протонов. Эта их способность реализуется при построении нуклеиновых кислот (разд. 23.4).
Среди оксопроизводных пурина следует выделить кофеин и мочевую кислоту. Кофеин содержится в кофейных зернах, бобах какао и чайных листьях. Это сильнодействующий возбудитель центральной нервной системы и стимулятор работы сердца. Кофеин является основанием и образует соли с кислотами.

Мочевая кислота - продукт обмена веществ в живых организ-мах. В значительных количествах встречается в экскрементах птиц (= 25 %) и особенно змей (= 90 %). Мочевая кислота является двухосновной NH-кислотой (рКа 1= 5,4, а р Ка 2 = 11,3) и образует два ряда солей-уратов, большинство из которых, как и сама мочевая кислота, плохо растворяются в воде.
Дата публикования: 2014-10-16; Прочитано: 5570 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
