 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Особенности биохимических окислительно-восстановительных процессов в организмах
|
|
Все биохимические окислительно-восстановительные процессы, скорость и глубина которых контролируется организмом, совершаются в присутствии ферментов с общим названием оксидоредуктазы. В состав оксидоредуктаз всегда входят кофакторы или коферменты. Кофакторами являются катионы переходных металлов (обычно железо и медь, а иногда марганец и молибден), образующие с белком фермента комплексное соединение (разд. 10.4). Коферменты - сложные органические соединения, достаточно прочно связанные с белком фермента (разд. 9.3.2). Основная особенность кофакторов и коферментов заключается в их способности быть и окислителем, и восстановителем, так как каждый из них может находиться в двух сопряженных формах: окисленной и восстановленной. Таким образом, оксидоредукта-зы проявляют окислительно-восстановительные свойства за счет своих кофакторов или коферментов.
Состав конечных продуктов расщепления молекул сложных органических соединений при аэробных и анаэробных условиях, как видно из приведенных реакций, резко различается в случае углеродсодержащих продуктов. При аэробном окислении эти продукты содержат только 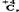 а в анаэробных условиях образуются углеродсодержащие продукты, в которых атомы углерода могут иметь широкий спектр степеней окисления:
а в анаэробных условиях образуются углеродсодержащие продукты, в которых атомы углерода могут иметь широкий спектр степеней окисления:

из схемы видно, что при биологическом окислении органических соединений изменяются только степени окисления входящих в их состав атомов углерода, поскольку степени окисления всех других атомов (водорода, азота и серы) остаются постоянными. Поэтому при описании превращений органических соединений необходимо учитывать степень окисления каждого атома углерода (разд. 9.3.1).
Ступенчатость биохимических окислительно-восстановительных реакций. Особенностью биохимических реакций окисления-восстановления является их многоступенчатость: образование множества различных промежуточных продуктов. При этом все биохимические окислительно-восстановительные процессы: гликолиз, р-окисление жирных кислот, цикл Кребса, окислительное фосфорилирование и другие - включают много различных стадий, каждая из которых совершается под действием определенных ферментов. Все необходимые ферменты для каждой стадии данного процесса объединены за счет межмолекулярных связей в ансамбли с четкой пространственной организацией. Ансамбли ферментов, как правило, фиксируются на различных клеточных мембранах. В результате слаженного во времени и пространстве действия всех ферментов ансамбля химические превращения субстрата осуществляются постепенно, как на конвейере. При этом продукт реакции одной стадии является исходным соединением для следующей стадии.
Ступенчатый механизм протекания биохимических окислительно-восстановительных реакций создает возможность функционального контроля образования веществ на каждой стадии.
Тем самым организм предотвращает нежелательные для него изменения в процессе метаболизма, которые, если и возникают, то благодаря многоступенчатости процесса не резко, а плавно, постепенно. Вследствие ступенчатости для биохимических окислительно-восстановительных реакций становится более вероятной обратимость отдельных стадий. Это обеспечивает реакции, направленной в сторону равновесия, самопроизвольное протекание и способствует поддержанию окислительно-восстановительного гомеостаза в организме.
Нормальный восстановительный потенциал. Одной из особенностей биохимических окислительно-восстановительных процессов в живых организмах, является то, что большинство из них протекает в нейтральной водной среде. Поэтому для характеристики окислительно-восстановительных свойств природных сопряженных пар вместо стандартных значений потенциалов ф°, которые соответствуют рН = 0 или рН = 14 (рОН = 0), используют нормальные значения восстановительных потенциалов 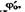 измеренные при 1 М концентрации компонентов и при pH = 7,0 (табл. 9.2). Пои этих условиях значение потенциала водородного электрода.
измеренные при 1 М концентрации компонентов и при pH = 7,0 (табл. 9.2). Пои этих условиях значение потенциала водородного электрода. 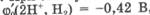 , а соотношение между значе-
, а соотношение между значе-
ниями нормального и стандартного восстановительных потенциалов соединения выражается уравнением: 
 |
Все природные сопряженные окислительно-восстановительные пары имеют потенциалы в области значений -0,42 + +0,82 В, характеризующих электрохимическую устойчивость воды. При потенциале ниже —0,42 В начинается восстановление воды с образованием молекулярного водорода, а при потенциале выше +0,82 В происходит окисление воды с образованием молекулярного кислорода.
Экзэргоничность реакций биологического окисления. Реакции биологического окисления являются экзэргоническими и служат источниками энергии, необходимой для различных жизненных процессов. Поэтому многие реакции биологического окисления сопряжены с фосфорилированием АДФ с образованием АТФ, в результате происходит аккумулирование энергии окислительно-восстановительных реакций в организме. В то же время в организме некоторые реакции окисления сопряжены с реакциями восстановления, которые эндэргоничны (разд. 9.3.3).
Классификация биохимических окислительно-восстановительных процессов. В биохимической литературе широко распространено мнение, что биологическое окисление связано только с взаимодействием субстрата с кислородом и его производными или с дегидрированием субстрата. В действительности кроме этих процессов очень большое число биохимических реакций, протекающих внутримолекулярно в присутствии ферментов, имеет окислительно-восстановительный характер. Поэтому протекающие в организме окислительно-восстановительные процессы предлагается разделить на следующие типы.
1. Реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода (разд. 9.3.2).
2. Реакции, протекающие с участием оксидоредуктаз:
- дегидрогеназного окисления-восстановления (разд. 9.3.5 - 9.3.7);
- оксигеназного окисления-восстановления (разд. 9.3.8).
3. Свободнорадикальное окисление-восстановление (разд. 9.3.9).
Дата публикования: 2014-10-16; Прочитано: 11868 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
