 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Протолитический баланс. Буферные растворы и их свойства
|
|
Одним из важнейших факторов общего гомеостаза живых организмов является поддержание кислотно-щелочного, т. е. протолитического, баланса на необходимом уровне. Это выражается в достаточно постоянных значениях рН биологических сред и в способности восстанавливать рН при поступлении в эти среды кислот и оснований. В результате жизнедеятельности в организме образуется большое количество кислот. Больше всего при метаболизме возникает углекислоты (до 13 моль ежесуточно), которая в основном выводится из организма при дыхании в виде оксида углерода(4). Задержка или нарушение выделения углекислоты из организма приводит к серьезным патологиям, так как согласно расчетам для нарушения кислотно-основного баланса у человека достаточно задержки в организме всего 0,15 моль кислоты.
Помимо угольной кислоты в организме образуются нелетучие кислоты (серная, фосфорная, молочная и др.) в количестве 0,03-0,08 моль/сут. При вегетарианском питании кислот образуется меньше, а при употреблении продуктов животного происхождения - больше. При некоторых патологических процессах, например при диабете, нелетучих кислот образуется значительное количество (до 1 моль/сут), причем в основном это ацетоуксусная и Р-оксимасляная кислоты. Возникающее при диабете нарушение протолитического баланса может угрожать жизни больного. От кислот организм освобождается благодаря физиологическим процессам: дыханию (от летучей кислоты СО2) и мочевыделению (в основном, от нелетучих кислот).
Роль оснований в организме обычно выполняют различные азотистые основания, включая аммиак, которые образуются в результате метаболизма аминокислот и белков. Эти основания или используются в процессах дальнейшего метаболизма, или выводятся из организма через почки.
С помощью физиологических процессов кислоты и основания выводятся из организма медленно, а быстрая их нейтрализация и поддержание рН жидких сред на необходимом уровне осуществляется за счет физико-химических процессов, среди которых прежде всего следует отметить протолитическое равновесие в буферных системах. Для понимания работы этих систем рассмотрим состав и механизм действия буферных растворов.
Буферные растворы. Большинство биожидкостей организма способно сохранять значение рН при незначительных внешних воздействиях, так как они являются буферными растворами.
Буферный раствор - это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянное значение рН при разбавлении или при добавлении небольших количеств кислоты или щелочи.
В протолитических буферных растворах компонентами являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару. В качестве донора протона выступает слабая кислота (СН3СООН, Н2СО3) или сопряженная кислота слабого основания (NН4+). Акцептором протона в первом случае является анион слабой кислоты (СНзСОО-, НСОз), а во втором - слабое основание (NH3 • Н2О). Состав протолитической буферной системы выражают формулами ее компонентов, причем вначале указывают формулу акцептора протона, а затем - донора протона, разделяя их запятой. Например, буферные системы: ацетатная – СНзСОО-, СН3СООН; гидрокарбонатная - НСО3-, Н2СО3; аммиачная - NH3 * Н2О, NH4+. По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на кислотные и основные.
Кислотными буферными системами называются растворы, содержащие слабую кислоту (донор протона) и соль этой кислоты (акцептор протона).
Кислотные буферные растворы могут содержать различные системы: ацетатную (СН3СОО-, СН3СООН), гидрокарбонатную (НС03-, Н2С03), гидрофосфатную (НРO42-, Н2РO4-). В кислотной буферной системе всегда наблюдается два процесса: один обратимый - диссоциация слабого протолита:

другой необратимый - диссоциация соли:

В результате этих процессов образуется акцептор протона ацетат-ион (СН3СОО-), концентрация которого в растворе определяется в основном концентрацией соли CH3COONa, так как образование аниона за счет диссоциации слабой кислоты в присутствии ее соли всегда очень незначительно. Поскольку концентрация ацетатиона, акцептора протона, определяется концентрацией соли, то в соответствии с уравнением Гендерсона -Хассельбаха рН кислотной буферной системы зависит от показателя константы диссоциации слабой кислоты рКа и отношения концентраций акцептора протона (соли) и донора протона (кислоты) в растворе:

Основными буферными растворами называются растворы, содержащие слабое основание (акцептор протона) и соль этого основания (донор протона).
Примером основного буферного раствора является водный раствор, содержащий систему из слабого основания NH3 • Н20 и его соли NH4C1. В основной буферной системе также протекают два процесса:
 |
Концентрация катионов NH4+ (доноров протона) в аммиачном буфере определяется в основном концентрацией соли (NH4C1). Величина рН основного буферного раствора, согласно уравнению Гендерсона - Хассельбаха, зависит от величины рK0(ВН+) сопряженной кислоты данного основания и отношения концентраций основания и его соли в растворе:

Механизм буферного действия. При разбавлении буферных растворов концентрации всех компонентов уменьшаются. Но так как они изменяются одинаково, то их отношение остается неизменным. Величина константы диссоциации слабого электролита также не изменяется при разведении. Поэтому рН буферного раствора, согласно уравнению Гендерсона - Хассельбаха, при разбавлении не меняется. В действительности это наблюдается до тех пор, пока концентрация компонентов буферных растворов не станет меньше 0,01 моль/л.
Добавление небольших количеств сильной кислоты или щелочи в буферный раствор моментально вызывает защитную реакцию протолитической буферной системы по поддержанию постоянного значения рН среды. Это происходит за счет связывания добавляемых ионов Н+ или ОН- соответствующими компонентами буферной системы с образованием малодиссоциирующих соединений. Катионы Н+ связываются акцептором протона буферной системы:

Защитные свойства буферных растворов по отношению к действию кислот и щелочей будут сохраняться до тех пор, пока концентрации компонентов буферных систем, связывающих Н+ или ОН, будут больше концентрации добавляемых ионов:

Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более чем в 10 раз:

Таким образом, на основании одного слабого электролита можно приготовить буферные растворы, поддерживающие значение рН в относительно узком диапазоне от 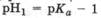 до
до 
Буферная емкость. Протолитические буферные растворы способны поддерживать значение рН среды на определенном уровне только при добавлении к ним небольших количеств кислоты или щелочи. Для количественной характеристики этой сопротивляемости буферных растворов к добавлению кислот и оснований введено понятие буферная емкость.
Буферной емкостью (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину рН на единицу.
Различают буферную емкость по кислоте Ва и буферную емкость по основанию Вb, которые рассчитываются с помощью уравнений:

где с(1/z к-ты) и Ук_ты - молярная концентрация эквивалентов и объем добавленной сильной кислоты; с(1/z щел) и Vщел - молярная концентрация эквивалентов и объем добавленной щелочи; ДрН - сдвиг водородного показателя буферного раствора, вызванный добавлением сильной кислоты (щелочи); Vбуф. р-ра - исходный объем буферного раствора.
Буферная емкость зависит от концентраций компонентов в буферном растворе и их отношения. Чем выше концентрация компонентов, тем больше буферная емкость. Кислотная буферная емкость определяется концентрацией буферного основания, т. е. концентрацией акцептора протона: Ва = f /([акцептор протона]). Основная буферная емкость определяется концентрацией буферной кислоты, т. е. концентрацией донора протона: Вb = = f([донор протона]). При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации всех компонентов раствора.
При одинаковой суммарной концентрации компонентов буферная емкость достигает максимального значения при равенстве их концентраций: (донор протона) = [акцептор протона], причем в этом случае 
Дата публикования: 2014-10-16; Прочитано: 5980 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
