 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
|
|
Наряду с кислотно-основным взаимодействием, в основе которого лежит обмен протоном (Н+) между реагентами, в природе широко распространено окислительно-восстановительное взаимодействие, которое характеризуется перераспределением электронов между реагентами.
Окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними. В окислительно-восстановительных реакциях всегда происходят отдача и присоединение электронов.
Окислением называется процесс отдачи электронов атомом вещества, сопровождающийся повышением степени его окисления.
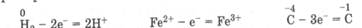 |
Например:
Восстановлением называется процесс присоединения электронов атомом вещества, сопровождающийся понижением степени его окисления.
Например:

В ходе окислительно-восстановительной реакции оба процесса протекают одновременно, причем общее число электронов, отданных при окислении, равно общему числу электронов, принятых при восстановлении.
Окислителем называется вещество, в состав которого входят атомы, присоединяющие электроны, т. е. окислитель - акцептор электронов.
Восстановителем называется вещество, в состав которого входят атомы, отдающие электроны, т. е. восстановитель - донор электронов. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряженный восстановитель:

Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряженный окислитель:

Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений - окисления и восстановления:
 |
 |
Например:
Совокупность окислителя(восстановителя) с продуктом его превращения составляет сопряженную окислительно-восстановительную пару, а ее взаимопревращение является полуреакцией восстановления (окисления). В любой окислительно-восстановительной реакции принимают участие две сопряженные окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т. е. восстановлением, другая - с отдачей электронов, т. е. окислением.
 ре-
ре-
для правильного обозначения сопряженной окислительно-восстановительной пары вначале следует записывать окисленную, а затем - восстановленную форму вещества.
Взаимодействие веществ в окислительно-восстановительных реакциях, как и в других химических реакциях, подчиняется закону эквивалентов.
Эквивалентом окислителя или восстановителя называется его частица (реальная или условная), которая, соответственно, присоединяет или отдает один электрон.
Молярная масса эквивалента 1/z М(Х) окислителя или восстановителя равна их молярной массе М(Х), умноженной на фактор их эквивалентности 1/z в данной реакции. Фактор эквивалентности окислителя или восстановителя равен 1/z где z - число электронов, принятых или отданных одной частицей (молекулой, атомом, ионом) окислителя или восстановителя. Поэтому молярная масса эквивалента окислителя или восстановителя вычисляется по уравнению:
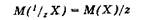
Факторы, влияющие на протекание окислительно-восстановительных реакций. Характер протекания окислительно-восстановительных реакций зависит от химической природы взаимодействующих веществ и от условий проведения реакции:

Как видно из анализа приведенных полуреакций, в окислительно-восстановительных реакциях, протекающих в водных растворах, часто принимают участие вода или ее ионы Н+ и ОН-, которые не только способствуют передаче электронов от восстановителя к окислителю, но и связывают компоненты данных превращений. Особенно это важно для биохимических окислительно-восстановительных реакций, всегда протекающих в водных растворах.
Дата публикования: 2014-10-16; Прочитано: 12712 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
