 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Общая, активная и потенциальная кислотность растворов
|
|
Содержание кислот как в физиологических жидкостях, так и в окружающей организм среде относится к факторам, влияющим на функционирование клеток, органов и организма в целом. Поэтому определение кислотности желудочного сока, крови, мочи относится к числу анализов, выполняемых в целях диагностики заболеваний и контроля за ходом лечения. Своевременный и полный контроль за кислотностью почв - необходимое условие обеспечения высоких урожаев. Решение многих проблем, связанных с охраной окружающей среды, требует знаний о содержании кислотных и основных веществ в природных источниках, дождевой воде и промышленных стоках предприятий до и после их очистки.
Для количественной характеристики кислотных свойств растворов пользуются величинами общей, активной и потенциальной кислотности, которые обозначаются соответственно [Н+]0бщ, [Н+]акт, [Н+]пот и выражаются в моль/л.
Общая кислотность - это концентрация всех катионов Н+ (свободных и связанных), имеющихся в растворе.
 |
Общая кислотность равна сумме молярных концентраций эквивалентов всех кислот (сильных и слабых), находящихся в растворе:
Общая кислотность растворов определяется методом нейтрализации смеси кислот раствором щелочи с известной концентрацией. Из-за наличия в растворах слабых кислот окончание нейтрализации всех кислот определяют с помощью индикатора фенолфталеина, интервал перехода окраски которого лежит в щелочной области рН 8,3-10,0.
Способность кислот к ионизации зависит от их силы, и поэтому в растворах они могут находиться как в виде ионов, так и в виде молекул. Поэтому для характеристики свойств растворов, обусловленных наличием свободных катионов Н+, пользуются величиной активной кислотности.
Активная кислотность - это концентрация свободных катионов Н+, имеющихся в растворе при данных условиях.
 |
Мерой активной кислотностиявляется значение рН раствора
В растворах сильной кислоты активная кислотность зависит от концентрации кислоты и межионного взаимодействия и рассчитывается по формуле:

где ун+ - коэффициент активности катиона Н+ в данном растворе.
Поскольку при разбавлении раствора ун+ — 1, то в сильно разбавленных растворах (с < 0,1 М) сильных кислот [Н+]акт —> [Н+]общ
Слабые кислоты в растворах присутствуют в ионизованной и молекулярной формах, и активная кислотность их растворов рассчитывается по формулам:

где Kа и pKа - константа и показатель кислотности слабой кислоты.
Однако приведенные формулы справедливы только при отсутствии в растворе сильной кислоты, которая подавляет диссоциацию слабой кислоты практически полностью. Поэтому активная кислотность растворов обычно характеризует содержание в них сильных кислот:

Экспериментально [Н+]акт определяют, измеряя рН анализируемого раствора с помощью рН-метра. При отсутствии рН-метра активную кислотность определяют методом нейтрализации кислот раствором щелочи с известной концентрацией в присутствии индикатора, имеющего область перехода окраски в интервале АрН = 2-4, например диметиламиноазобензол (АрН = 2,4 - 4,0), метилоранж (АрН = 3,1 - 4,4). В присутствии таких индикаторов определяемая точка эквивалентности соответствует нейтрализации только сильных кислот.
Для учета содержания в растворе связанных катионов водорода, содержащихся в молекулярных формах слабых кислот, используют еще одну величину - потенциальную (или связанную) кислотность.
Потенциальная кислотность - это концентрация катионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе.
Потенциальная кислотность равна разности между общей и активной кислотностями раствора:
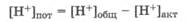
Потенциальная кислотность раствора, содержащего только сильные кислоты, очень мала ([Н+]пот -> 0), вследствие полной ионизации этих кислот. Потенциальная кислотность растворов в основном обусловлена содержанием в них недиссоциированных молекул, особенно в присутствии сильных кислот, которые подавляют ионизацию слабых кислот.
Потенциальная кислотность раствора практически равна суммарной молярной концентрации эквивалентов слабых кислот:

Таким образом, общая кислотность раствора равна сумме молярных концентраций эквивалентов содержащихся сильных и слабых кислот:

При анализе кислотности раствора, содержащего сильные и слабые кислоты, реакция нейтрализации протекает в две стадии. Сначала нейтрализуются свободные ионы водорода, т. е. сильные кислоты (I стадия), после чего идет нейтрализация слабых кислот (II стадия). Каждой стадии нейтрализации соответствуют своя точка эквивалентности и свой скачок рН на кривой нейтрализации (рис. 8.4), которые можно зафиксировать не только с помощью рН-метра, но и с помощью двух индикаторов. Вблизи I точки эквивалентности, хотя кривая нейтрализации и имеет отчетливый перелом, но резкого скачка рН не наблюдается, так как уменьшение содержания свободных ионов Н+ в ходе нейтрализации пополняется за счет диссоциации слабой кислоты (рис. 8.4). Поэтому значение рН в I точке эквивалентности соответствует значению рН раствора слабой кислоты (рН = 2,8-3,5) и фиксируется индикаторами, изменяющими цвет при этих значениях рН.
Во II точке эквивалентности, лежащей на более резком скачке нейтрализации, где полностью нейтрализуются слабые кислоты, из-за гидролиза их анионов среда в растворе щелочная, и II точка фиксируется с помощью соответствующего индикатора - фенолфталеина.
В биохимических исследованиях для характеристики кислотности желудочного сока различают следующие показатели:
- концентрацию свободной соляной кислоты, соответствующую активной кислотности [Н+]акт;
- концентрацию связанной соляной кислоты, обусловленную наличием хлороводородных солей белков и некоторых других азотсодержащих соединений, нейтрализующихся по уравнению: 
Реакция нейтрализации хлороводородных солей, а также органических кислот с рКа < 4 заканчивается при рН 6 - 7 и фиксируется индикатором ализаринсульфоновокислый натрий (АрН = 5,0 - 6,8) или с помощью рН-метра.
- концентрацию ди- и моногидрофосфатов и слабых органических кислот, нейтрализация которых заканчивается при рН
8,5-9,0 и фиксируется индикатором фенолфталеин.

Рис. 8.4. Кривая нейтрализации смеси кислот сильным основанием
- общую кислотность, концентрацию всех кислот желудочного сока:

В клинической практике кислотность желудочного сока выражается в клинических (титрационных) единицах, т. е. числом миллилитров 0,1 М щелочи, которое необходимо затратить для нейтрализации 100 мл профильтрованного желудочного сока, чтобы получить требуемое значение рН (pH1 ~ 3,0; рН2 ~ 6,8; рН3 ~ 9,0) в анализируемой пробе. В норме общая кислотность составляет 40-60 ммоль/л (клинических единиц), а активная кислотность, т. е. содержание свободной соляной кислоты, составляет 20-40 ммоль/л. Повышенное содержание кислот наблюдается при язвах желудка, двенадцатиперстной кишки, некоторых формах гастрита и ряде заболеваний нервной системы. Пониженная кислотность имеет место при острых инфекционных заболеваниях, хронических гастритах, раке желудка.
В санитарной практике для количественного содержания кислотных и щелочных веществ в промышленных стоках используют показатели: общая, активная и потенциальная кислотность, указывающие на содержание различных кислот; а также показатели: общая, активная и потенциальная щелочность, характеризующие содержание оснований и определяемые аналогичным путем.
Дата публикования: 2014-10-16; Прочитано: 44887 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
