 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гидролиз солей. При растворении некоторых солей в воде самопроизвольно протекают не только диссоциация их на ионы и гидратация ионов
|
|
При растворении некоторых солей в воде самопроизвольно протекают не только диссоциация их на ионы и гидратация ионов, но и процесс гидролиза солей.
Гидролиз солей - это протолитический процесс взаимодействия ионов солей с молекулами воды, в результате которого образуются малодиссоциирующие молекулы или ионы.
Способность ионов солей подвергаться гидролизу и его глубина зависят прежде всего от свойств ионов, образующих соль. Соли, образованные катионом сильного основания и анионом сильной кислоты, например NaCl, KN03, Na2S04, КСlO4, гидролизу не подвергаются, так как ни катион, ни анион этих солей не могут при взаимодействии с водой образовывать молекулы слабых электролитов. Поэтому в водных растворах этих солей величина рН практически не меняется и совпадает с рН воды при той же температуре, т. е. среда остается практически нейтральной.
Малорастворимые соли, например РЬС12, ВаСОз, из-за низкой концентрации ионов в водных растворах практически не гидролизуются.
Гидролизу подвергаются только те соли, которые содержат ионы, соответствующие слабым кислотам или слабым основаниям. С позиции протолитической теории гидролиз ионов солей заключается в переходе протона от молекулы воды к аниону соли или от катиона соли (с учетом его гидратации) к молекуле воды. Таким образом, в зависимости от природы иона вода выступает либо как кислота, либо как основание, а ионы соли при этом являются соответственно сопряженным основанием или сопряженной кислотой.
Возможны три варианта гидролиза ионов солей:
1) гидролиз по аниону - соли, содержащие катион сильного основания и анион слабой кислоты;
2) гидролиз по катиону - соли, содержащие катион слабого основания и анион сильной кислоты;
3) гидролиз и по катиону, и по аниону - соли, содержащие катион слабого основания и анион слабой кислоты.
Рассмотрим эти случаи гидролиза.
гидролиз по аниону. Соли, содержащие анионы слабых кислот, например ацетаты, цианиды, карбонаты, сульфиды, взаимодействуют с водой, так как эти анионы являются сопряженными основаниями, способными конкурировать с водой за протон, связывая его в слабую кислоту:

При этом взаимодействии возрастает концентрация ОН", и поэтому рН водных растворов солей, гидролизующихся по аниону, всегда находится в щелочной области (рН > 7). Гидролиз многозарядных анионов слабых кислот в основном протекает по I ступени.
Для характеристики состояния равновесия при гидролизе солей используют константу гидролиза Кг, которая при гидролизе по аниону равна:

где КH2O - ионное произведение воды (разд. 7.4); Ка — константа диссоциации слабой кислоты НА.
Из этого уравнения видно, что чем слабее кислота, тем полнее гидролиз.
 |
Расчет рН раствора соли, гидролизующейся по аниону, проводят по формуле:
где с(А-) - концентрация аниона, численно равная или кратная концентрации соли.
В соответствии с принципом смещения химического равновесия для подавления гидролиза, протекающего по аниону, к раствору соли следует добавить щелочь как поставщик иона ОН~, образующегося при гидролизе соли по аниону (ион, одноименный продукту гидролиза).
 |
Гидролиз по катиону. Соли, содержащие катионы слабых оснований, например катионы аммония, алюминия, железа, цинка, взаимодействуют с водой, так как являются сопряженными кислотами, способными отдавать протон молекулам воды или связывать ионы ОН- молекул воды с образованием слабого основания. При этом лучше учитывать, что катионы металлов в водных растворах гидратированы:
 |
При гидролизе по катиону в растворе возрастает концентрация Н+ и рН водного раствора таких солей всегда находится в кислой области (рН < 7). Константа гидролиза в этом случае рассчитывается по формуле:
Равенство Кг соли, гидролизующейся по катиону, величине Ка(ВН+) следует из уравнения гидролиза по катиону, которое идентично уравнению диссоциации сопряженной кислоты слабого основания, содержащего данный катион, в присутствии воды.
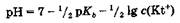 |
Расчет рН раствора соли, гидролизующейся по катиону, проводят по уравнению
Если вместо показателя рКb использовать рКа(ВН+) сопряженной кислоты данного основания, то в этом случае, учитывая, что рКb = 14 - рКa(ВН+), получаем уравнение:

где c(Kt+) - концентрация катиона в растворе.
Для подавления гидролиза, протекающего по катиону, к раствору соли необходимо добавить сильную кислоту как поставщик иона Н+, одноименного продукту гидролиза.
Гидролиз по катиону и по аниону. В этом случае в реакции гидролитического взаимодействия с водой участвуют одновременно и катионы, и анионы, а реакция среды определяется природой более сильного протолита.

Если гидролиз по катиону и по аниону протекает в равной степени (кислота и основание - одинаково слабые электролиты), то раствор соли имеет нейтральную реакцию; например, водный раствор ацетата аммония NH4CH3COO имеет рН = 7, так как рKа(СН3СООН) = 4,76 и рKb(NH3* Н20) = 4,76.
Если в растворе преобладает гидролиз по катиону (основание слабее кислоты), раствор такой соли имеет слабокислую реакцию (рН < 7), например нитрит аммония NH4N02 (рKа(HN02) = 3,29).
Если в растворе преобладает гидролиз по аниону (кислота слабее основания), то раствор такой соли имеет слабощелочную реакцию (рН > 7), например цианид аммония NH4CN (рKа(HCN) = 9,31).
Константу гидролиза солей, гидролизующихся и по катиону, и по аниону, рассчитывают по формуле:

 |
а расчет рН раствора таких солей ведут по формуле:
Следует отметить, что согласно последнему уравнению рН водных растворов солей, гидролизующихся и по катиону, и по аниону, не зависит от концентрации соли.
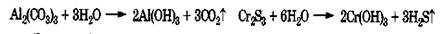 |
Некоторые соли, гидролизующиеся по катиону и по аниону, например сульфиды или карбонаты алюминия, хрома, железа(Ш), гидролизуются полностью и необратимо, так как при взаимодействии их ионов с водой образуются малорастворимые основания и летучие кислоты, что способствует протеканию реакции до конца:
Эту особенность гидролизаподобных солей следует обязательно учитывать при сливании сточных вод, чтобы избежать их вспенивания за счет образования С02 или отравления окружающей среды сероводородом.
Глубина протекания гидролиза солей в значительной степени зависит и от внешних факторов, в частности от температуры и концентрации раствора. При кипячении растворов гидролиз солей протекает значительно глубже, а охлаждение растворов, наоборот, уменьшает способность соли подвергаться гидролизу. Увеличение концентрации большинства солей в растворах также уменьшает гидролиз, а разбавление растворов заметно усиливает гидролиз солей.
Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и других физиологических жидкостей. Действие многих химиотерапевтических средств связано с их кислотно-основными свойствами и склонностью к гидролизу. С этими свойствами необходимо считаться и при решении вопросов о допустимости одновременного назначения пациенту различных препаратов.
Дата публикования: 2014-10-16; Прочитано: 9991 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
