 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Протолитическая теория кислот и оснований
|
|
Понятия "кислота" и "основание" применяют по отношению к двум группам соединений, обладающих совокупностью диаметрально противоположных свойств. В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований. Согласно этой теории понятиям кислота и основание отвечают следующие определения.
 |
Кислота - молекула или ион, способные отдавать катион водорода (протон). Кислота - донор протонов.
Основание - молекула или ион, способные присоединять катион водорода (протон). Основание - акцептор протонов.

Кислота, отдавая протон, превращается в частицу, стремящуюся его принять, которая называется сопряженным основанием:
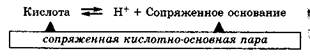
Основание, присоединяя протон, превращается в частицу, стремящуюся его отдать, которая называется сопряженной кислотой:

Совокупность кислоты и ее сопряженного основания или основания и его сопряженной кислоты называются сопряженными кислотно-основными парами.
Сила кислоты определяется ее способностью отдавать протон, т. е. сильная кислота - активный донор протона. Сила кислот в водных растворах уменьшается в ряду:
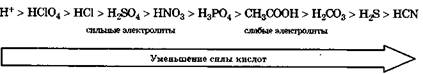
 |
Сила основания определяется его способностью присоединять протон, т. е. сильное основание - активный акцептор протона. Сила оснований в водных растворах, т. е. их сродство к протону, уменьшается в ряду:
Сильные кислоты, легко отдавая протон, превращаются в сопряженные основания, которые плохо присоединяют протон. Поэтому диссоциация этих кислот протекает практически необратимо:
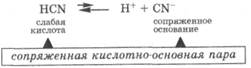
Слабые кислоты, трудно отдавая протон, превращаются в сопряженные основания, которые активно принимают протон, что делает диссоциацию слабых кислот обратимым процессом, причем равновесие смещено в сторону недиссоциированной формы:
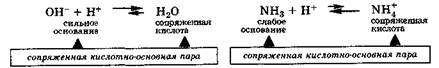
Аналогичным образом ведут себя сильные и слабые основания, превращаясь в результате реакции в соответствующие сопряженные кислоты, т. е. и в этих случаях также имеются сопряженные кислотно-основные пары:
Некоторые вещества способны выступать в одних реакциях в роли донора протона, отдавая его соединениям, у которых сродство к протону выше, а в других - в роли акцептора протона, отнимая его у соединений с меньшим сродством к протону. Такие вещества называются амфолитами.
Амфолиты - молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований. Амфолит проявляет свойства кислоты или основания в зависимости от того, с какими веществами он взаимодействует. Типичным амфолитом является вода, так как в результате ее электролитической диссоциации образуются одновременно сильная кислота и сильное основание:
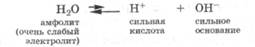
Кроме того, вода взаимодействует и с кислотами, выступая основанием, и с основаниями, проявляя свойства кислоты:
 |
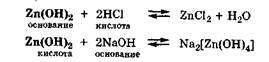 |
Амфолитами являются гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
Амфолитами являются гидроанионы многоосновных кислот, например НС03-, НР042-и Н2РО4-.

Амфолитами являются также соединения, молекулы которых содержат две различные кислотно-основные группы, например важные в биологическом отношении а-аминокислоты. Молекула а-аминокислоты в результате переноса протона от карбоксильной группы на аминогруппу превращается из таутомера*, не содержащего заряженные группы, в таутомер, имеющий биполярно-ионную (цвиттерионную) структуру. Таким образом, для а-аминокислот характерна прототропная таутомерия (разд. 21.2.1).
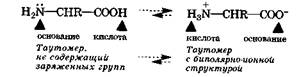
В кристаллическом состоянии и в водных растворах это равновесие для а-аминокислот практически полностью смещено в сторону таутомера с биполярной структурой. Так, для глицина в водном растворе содержание таутомера с биполярно-ионной структурой в 223 000 раз больше, чем другого таутомера.
Вследствие этой особенности строения молекулы а-аминокислот проявляют кислотные свойства за счет аммонийной группы (NH3+), а основные - за счет ионизованной карбоксильной группы (—СОО-), выступая амфолитами:

Как и все амфолиты, а-аминокислоты являются слабыми электролитами.
Согласно протолитической теории кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основанию называется протолизом и объясняется тем, что эти два вещества имеют разное сродство к протону. В кислотно-основном взаимодействии всегда участвуют две сопряженные кислотно-основные пары, и переход протона всегда происходит в сторону образования более слабых кислот, включая сопряженные. Если склонность к взаимодействию с протоном у реагентов соизмерима, то наблюдается протолитическое равновесие.
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон (Н+) между основаниями взаимодействующих сопряженных кислотно-основных пар (НА, А- и ВН+, В). Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты:

Схематично протолитическое равновесие можно представить следующей схемой:

Переход протона всегда происходит от сильной кислоты к аниону слабой кислоты, что сопровождается вытеснением слабой кислоты из ее соли под действием более сильной кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде (разд. 7.2). Так, ионизация слабой кислоты в водных растворах является следствием конкуренции за протон между анионом слабой кислоты и водой, выступающей основанием, т. е. акцептором протона. Этот процесс является обратимым и характеризуется константой равновесия Ка:

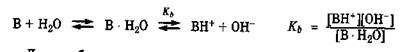 |
При взаимодействии слабого основания с водой последняя, выступая донором протона, способствует ионизации этого основания, носящей равновесный характер:
для слаоых электролитовсила кислот и оснований характеризуется величинами констант кислотности Ка и основности Кb ссоответственно (разд. 7.2). Если эти константы характеризуют протолитическое взаимодействие воды с кислотой или основанием одной сопряженной пары НА, А или ВН+, В, то произведение констант кислотности Ка и основности Kb, компонентов данной пары всегда равно ионному произведению воды Кн2о = 1 * 10-14 (при 22 °С):
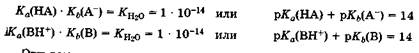
Эти выражения позволяют заменить в случае водных растворов константу основности Кь или показатель основности рКь слабого основания на константу кислотности Ка или на показатель кислотности рКа сопряженной кислоты этого основания. На практике для характеристики протолитических свойств соединения обычно используют величину рКа. Так, силу аммиака в воде как основания (pKb, = 4,76) можно охарактеризовать показателем кислотности иона аммония NH4+, т. е. сопряженной кислоты: рKа(NH4+) = 14 — 4,76 — 9,24. Поэтому в случае водных растворов нет необходимости в специальной таблице констант или показателя! основности, достаточно единой шкалы кислотности, представленной в табл. 8.1, где свойства оснований характеризуются констгантой Ка или показателем кислотности рКа их сопряженных кислот. Самой сильной кислотой в водных растворах является ка-тион водорода Н+ (точнее НзО+), а самым сильным основанием -анион ОН-. Величина рКа количественно характеризует силу слабьпх электролитов в водных растворах.
Слабая кислота тем слабее, чем больше значение ее рКа. Слабое основание тем слабее, чем меньше значение рКа его сопряженной кислоты.
Значение рКа равно значению рН водного раствора, в котоpoм данный слабый электролит ионизован на 50 %: поскольку в атом случае [А-] = [НА], то Ка = [Н+] и рКа = рН. Так, для уксусной кислоты в ее водном растворе с рН = рKа(СН3СООН) = = 4,76 имеет место равенство [СН3СОО-] = [СН3СООН], а для вод-Hoгo раствора аммиака равенство [NH4] = [NH3 ■ Н2О] будет наблюдаться в растворе с рН = рKа(NH4+) = 9,24.
Кроме того, значение рКа позволяет определить значение рН' водных растворов, где данная слабая кислота НА находится преимущественно (99 % и более) в виде аниона (А") - это будет в растворах с рН > рКа + 2; или в виде молекул (НА) - в растворах с рН < рКа - 2. В интервале АрН = рКа ± 2 слабый электролит в водных растворах существует и в ионизованной, и в неионизованной формах в соотношении [А-]/[НА] от 100: 1 до 1: 100 соответственно.

 |
Приведенные соотношения позволяют, зная величину рКа биосубстрата, определить, в какой форме он будет находиться при том или ином значении рН в водных системах организма. Кроме того, знание величины рКа слабого электролита позволяет рассчитать рН водных растворов этого электролита, если известна его концентрация.
Дата публикования: 2014-10-16; Прочитано: 28435 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
