 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Особенности ковалентной связи
|
|
Кроме характеристик, общих для любой химической связи (энергия и длина связи), ковалентная связь имеет дополнительные особенности: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
Кратность. Между соединяемыми атомами могут возникать одна, две или три ковалентные связи.
Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
При наличии одной общей электронной пары между соединяемыми атомами говорят о простой (ординарной) ковалентной связи. Например, в молекулах Н2, HF, F2, Н2О, NH3, СН4, С2Н6 или ионах ОН-, NH4, [Zn(OH)4]-2, [Сu(NHз)4]2+ все связи между атомами ординарные и являются а-связями.
При наличии у соединяемых атомов двух или трех общих электронных пар между ними возникает соответственно двойная или тройная связь. При этом одна связь — обязательно  -связь, остальные -
-связь, остальные -  -связи. Примерами могут служить молекулы или ионы, где между атомами есть кратные (двойные или тройные) связи:
-связи. Примерами могут служить молекулы или ионы, где между атомами есть кратные (двойные или тройные) связи:

 |
С увеличением кратности связи всегда уменьшается ее длина и повышается суммарная прочность:
Однако увеличение энергии связи, как видно из приведенных значений, не пропорционально увеличению кратности связи, что указывает на различия в энергиях  и
и  -связи, причем Еа > ЕП. Это объясняется тем, что эффективность перекрывания взаимодействующих атомных орбиталей в случае возникновения
-связи, причем Еа > ЕП. Это объясняется тем, что эффективность перекрывания взаимодействующих атомных орбиталей в случае возникновения  -молекулярной орбитали выше, чем при образовании
-молекулярной орбитали выше, чем при образовании  -молекулярной орбитали.
-молекулярной орбитали.
Насыщаемость. Каждый атом в соединении способен образовывать определенное число ковалентных связей. Благодаря насыщаемости ковалентных связей молекулы имеют определенный состав: Н2, Н2О, РС15, СН4.
Число возможных ковалентных связей, образуемых данным атомом, зависит при обменном механизме от числа неспаренных электронов на внешних энергетических уровнях у атомов в основном и возбужденном состояниях, а при донорно-акцепторном - еще и от числа свободных атомных орбиталей на внешних уровнях.
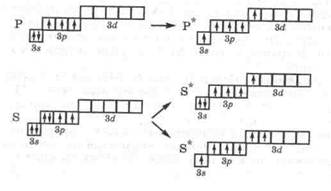
Число неспаренных электронов у атома данного элемента в основном состоянии определяется электронной структурой внешних уровней. Например, в основном состоянии внешний уровень атома углерода имеет структуру

Следовательно, в этом состоянии углерод имеет два неспаренных электрона и может образовывать две ковалентные связи по обменному механизму. Однако углерод в соединениях чаще всего образует четыре связи. Это объясняется тем, что на внешнем уровне в атоме углерода имеется свободная 2р-орбиталь, которая при возбуждении атома может быть частично занята за счет перехода одного электрона с 2s-орбитали с возникновением четырех неспаренных электронов:

Разъединение спаренных электронов и перенос их на новую орбиталь требует затрат энергии, однако этот расход энергии компенсируется с избытком выделением энергии за счет образования атомом углерода четырех ковалентных связей вместо двух. Аналогично можно объяснить образование бериллием всегда двух связей, а бором - трех. Начиная с третьего периода, у атомов р-элементов при возбуждении электроны внешних s- и р-подуровней могут переходить на свободный d-подуровень этого слоя, что приводит к увеличению числа возможных связей. Именно этим объясняется способность атомов фосфора образовывать в соединениях пять связей, атомов серы - четыре или шесть, а атомов хлора - три, пять и даже семь связей:
 |
При донорно-акцепторном механизме возникновения ковалентной связи катионы d-металлов обычно могут предоставлять 2, 4 или 6 свободных атомных орбиталей разного типа (s, р, d), что значительно расширяет их возможность образовывать ковалентные связи в комплексных соединениях: [Ag(NH3)2]+;[CuCl4]2-; [Fe(CN)6]-3.
Направленность. Атомные орбитали, участвующие в образовании молекулярных орбиталей, имеют различную форму и разную ориентацию в пространстве. Это обусловливает пространственную направленность ковалентных связей, образуемых атомом, поскольку соединяемые атомы стремятся к максимальному перекрыванию атомных орбиталей. Направленность ковалентных связей определяет пространственную структуру (геометрию) молекул, состоящих более чем из двух атомов.
Для объяснения геометрического строения молекул или ионов с учетом направленности ковалентной связи Л. Полинг предложил идею о гибридизации атомных орбиталей.
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами.
Гибридные орбитали имеют форму несимметричной восьмерки, сильно вытянутой в одну сторону от ядра:

 |
Такая форма обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов и приводит к образованию более прочных связей. Поэтому энергия, затрачиваемая на гибридизацию, с избытком компенсируется выделением энергии
Рис. 2.3. Пространственная структура молекул NH3, Н2О и гибридизация атомных орбиталей атомов азота и кислорода
за счет образования более прочных связей с участием гибридных атомных орбиталей. Название гибридных орбиталей определяется числом и типом участвующих орбиталей: sp-, sp2-, sp3-, sp2d-, s р3d2-гибридизация (табл. 2.2).
Направленность гибридных АО в пространстве, а следовательно, и геометрия молекул зависят от типа гибридизации. На практике обычно решается обратная задача: вначале экспериментально устанавливается геометрия молекулы, после чего описываются тип и форма АО, участвующих в ее образовании. Так, пространственная структура молекул NH3 и Н2О близка к тетраэдрической, поэтому считают, что атом азота в NH3 и атом кислорода в Н2О предоставляют для связывания с атомами водорода не чистые р-орбитали, а sр3-гибридные орбитали. Причем неподеленные электронные пары внешнего слоя атомов азота и кислорода также находятся на sр3-гибридных орбита-лях (рис. 2.3).
Таким образом, рассматривая ковалентные связи между атомами как результат взаимодействия атомных орбиталей, можно объяснить форму возникающих при этом частиц, которая зависит от числа и типа атомных орбиталей, участвующих в образовании связей. В табл. 2.2 указаны наиболее важные типы гибридизации и соответствующая им пространственная форма молекул или ионов.
Познакомившись с идеей о гибридизации атомных орбита-лей, необходимо понимать, что гибридизация представляет собой условный прием, позволяющий наглядно объяснить структуру молекулы путем комбинации атомных орбиталей.
Сопряжение ковалентных связей. Сопряжение ковалентных связей наблюдается в молекулах или ионах, когда по обе стороны от ординарной связи имеются кратные связи, л-МО которых частично перекрываются между собой с образованием общей  -МО (
-МО ( ,
,  -сопряжение). Другой случай сопряжения наблюдается, когда с одной стороны от ординарной связи имеется кратная связь, содержащая
-сопряжение). Другой случай сопряжения наблюдается, когда с одной стороны от ординарной связи имеется кратная связь, содержащая  -МО, а с другой — атом с неподеленной электронной
-МО, а с другой — атом с неподеленной электронной
парой на р-АО. В этом случае возможно частичное перекрывание данных  -МО и р-АО с образованием общей
-МО и р-АО с образованием общей  -МО (р,
-МО (р,  -сопряжение).
-сопряжение).
 |

Сопряжение связей - это взаимодействие л-электронов одной связи с  -электронами соседних связей (
-электронами соседних связей (  ,
,  -сопряжение) или с неподеленной электронной парой соседнего атома, находящейся на р-орбитали (р,
-сопряжение) или с неподеленной электронной парой соседнего атома, находящейся на р-орбитали (р,  -сопряжение), с образаванием единой делокализованной
-сопряжение), с образаванием единой делокализованной  -молекулярной орбитали, охватывающей все эти атомы в молекуле или ионе.
-молекулярной орбитали, охватывающей все эти атомы в молекуле или ионе.

В результате сопряжения  -связь становится многоцентровой, так как электронная плотность делокализованной
-связь становится многоцентровой, так как электронная плотность делокализованной  -МО, которая описывает движение образующих ее электронных пар, распределяется между несколькими атомными центрами, что в формулах соответствующих частиц схематично отражается пунктиром:
-МО, которая описывает движение образующих ее электронных пар, распределяется между несколькими атомными центрами, что в формулах соответствующих частиц схематично отражается пунктиром:

|
Вследствие сопряжения связей в рассматриваемых частицах длина двойных связей увеличивается, а ординарных - уменьшается. Делокализация электронов в сопряженных системах - самопроизвольный процесс, приводящий к выравниванию энергий отдельных связей и к общему энергетическому выигрышу, что придает повышенную устойчивость подобным системам.
Особенно большую роль сопряжение связей играет в молекуле бензола С6Н6, имеющей плоскую циклическую структуру и содержащей три двойные связи, чередующиеся с тремя простыми связями. Вследствие сопряжения шести л-электронов в молекуле бензола образуется единая замкнутая  -МО, равномерно охватывающая все атомы углерода. В результате все связи между атомами углерода оказываются идентичными, с длиной 139 пм (рис. 2.4.).
-МО, равномерно охватывающая все атомы углерода. В результате все связи между атомами углерода оказываются идентичными, с длиной 139 пм (рис. 2.4.).
Бензол относится к ароматическим соединениям. Молекулы таких соединений имеют плоские циклические (замкнутые) сопряженные системы, причем цикл может состоять не только из

|
атомов углерода, но и включать гетероатомы: азот, кислород, серу. При этом гетероатом имеет sp2 гибридизацию, а на его негибридизованной р-АО может находиться один электрон или электронная пара, которые принимают участие в образовании единой замкнутой  -МО, содержащей чаще всего 6 или 10 электронов. Важнейшие гетероароматические структуры, входящие в состав белков и нуклеиновых кислот, являются производными следующих азотсодержащих ароматических соединений (точкой отмечены электроны, участвующие в делокализации):
-МО, содержащей чаще всего 6 или 10 электронов. Важнейшие гетероароматические структуры, входящие в состав белков и нуклеиновых кислот, являются производными следующих азотсодержащих ароматических соединений (точкой отмечены электроны, участвующие в делокализации):

Таким образом, ароматическими называются такие ненасыщенные плоские циклические соединения, у которых все атомы цикла принимают участие в образовании единой замкнутой  -электронной системы (л-МО) за счет сопряжения ковалентных связей в молекуле.
-электронной системы (л-МО) за счет сопряжения ковалентных связей в молекуле.
 |
Полярность ковалентной связи. Ковалентная связь бывает полярной и неполярной. Неполярная ковалентная связь образуется между атомами элементов, имеющих одинаковую электроотрицательность. В этом случае электронная плотность молекулярной орбитали распределена абсолютно симметрично вокруг ядер соединяющихся атомов. Неполярная связь имеет место прежде всего в молекулах простых веществ: О2, N2, С12, а также между одинаковыми атомами в симметричных молекулах (Н3С—СН3, Н2С=СН2, НО—ОН, H2N—NH2).
Полярная ковалентная связь образуется между атомами разных элементов, отличающихся электроотрицательностью. В этом случае электронная плотность молекулярной орбитали общей электронной пары смещена к более электроотрицательному элементу, что приводит к появлению на атоме этого элемента частично отрицательного заряда  -, а на другом атоме - частично положительного заряда
-, а на другом атоме - частично положительного заряда  +, например в молекуле НСl. Эта молекула представляет собой диполь, так как центры распределения положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии l.
+, например в молекуле НСl. Эта молекула представляет собой диполь, так как центры распределения положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии l.
Мерой полярности связи служит дипольный момент  =
=  • I, где
• I, где  - заряд полюса диполя,
- заряд полюса диполя,
а I - длина диполя. Дипольный момент - величина векторная, причем за положительное направление обычно принимают направление от  + к
+ к  -. Единицей измерения полярности связи является Дебай (Д): 1Д = 3,3 * 10-30 Кл * м.
-. Единицей измерения полярности связи является Дебай (Д): 1Д = 3,3 * 10-30 Кл * м.
Полярность отдельных связей равна:

|
Следует различать полярность химической связи и полярность молекулы.
Для двухатомных молекул величина диполъного момента связи является мерой полярности молекул в целом. Для многоатомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей.

|
Таким образом, молекула будет полярной, если она содержит полярные связи и имеет несимметричную структуру, при которой центры распределения положительных и отрицательных зарядов в молекуле не совпадают.
Значения дипольного момента как связи, так и молекулы являются важными характеристиками их реакционной способности. Как правило, чем больше полярность системы, тем выше ее реакционная способность. Сильнополярная ковалентная связь под действием полярных молекул растворителя способна к гетеролитическому разрыву с образованием ионов; например, НСl - сильная кислота, так как ее молекулы в водных растворах полностью диссоциированы на ионы:

Вещества, молекулы которых полярны, обычно имеют более высокие температуры плавления и кипения, чем вещества с приблизительно той же молекулярной массой, молекулы которых неполярны.
Поляризуемость ковалентной связи. Наряду с полярностью связи или молекулы очень важное значение имеет понятие поляризуемость связи.
Поляризуемость химической связи - это способность электронной плотности этой связи смещаться под действием внешнего электрического поля или других воздействий.
Внешним электрическим полем относительно данной частицы может быть электрическое поле соседней полярной молекулы или соседнего иона. Во всех типах молекул - полярных и иеполярных, а также в атомах и ионах под действием внешнего электрического поля происходит смещение электронной плотности молекулярной или атомной орбитали, в результате возникает наведенный, или индуцированный, дипольный момент. Индуцированный диполь, хотя и существует только при наличии внешнего электрического поля, может вызывать резкое изменение реакционной способности отдельных связей и молекулы в целом. Поляризуемость связи зависит от подвижности общей электронной пары. Так, в молекуле HI подвижность общей электронной пары, а следовательно, и поляризуемость связи значительно больше, чем в молекуле HF, и поэтому связь HI под действием полярных молекул воды значительно легче диссоциирует на ионы, чем связь HF. Именно поэтому кислота HI относится к сильным, а кислота HF - к слабым кислотам, несмотря на более высокую полярность молекулы HF ( hf = = 1,5Д;
hf = = 1,5Д;  HI = 0,4Д). Этот пример наглядно показывает влияние поляризуемости ковалентной связи на ее реакционную способность.
HI = 0,4Д). Этот пример наглядно показывает влияние поляризуемости ковалентной связи на ее реакционную способность.
С поляризуемостью связи тесно связано понятие о поляризуемости атома, молекулы или иона, т. е. способности этих частиц трансформировать свои электронные оболочки под внешним воздействием. Поляризуемость атома, молекулы или иона прежде всего зависит от их размера и числа электронов. Чем меньше размер и число электронов у частицы, тем менее она поляризуема. Большие частицы с большим числом электронов будут легче поляризоваться. В зависимости от способности поляризоваться атомы, молекулы или ионы подразделяют на мягкие — легкополяризуемые частицы и жесткие - малополя-ризуемые частицы.

Понятие о "жесткости" и "мягкости" частиц важно при рассмотрении их реакционной способности в различных процессах. В соответствии с общим принципом "подобное с подобным" наиболее эффективно взаимодействуют "жесткие" частицы с "жесткими", а "мягкие" - с "мягкими". Особенно наглядно это проявляется в химии комплексных соединений (разд. 10.3).
Дата публикования: 2014-10-16; Прочитано: 4962 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
