 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Межмолекулярные взаимодействия
|
|
Термином межмолекулярные взаимодействия пользуются для описания всех типов взаимодействий между частицами, приводящих к образованию из них ассоциатов с достаточно определенной структурой. Возможность существования большинства веществ и в твердом и в жидком состоянии однозначно свидетельствует о том, что между молекулами этих веществ
действуют силы притяжения, которые принято называть межмолекулярными связями или взаимодействиями. Данное понятие используется и в тех случаях, когда речь идет о взаимодействиях с участием ионов, а также молекулярных и ионно-молекулярных ассоциатов. Поэтому эти взаимодействия в более общем виде можно называть "ассоциативными взаимодействиями". Иногда, особенно в молекулах биополимеров (белках, нуклеиновых кислотах и полисахаридах), наблюдается взаимодействие, т. е. ассоциация, между разными группами или атомами одной молекулы, которое, хотя и называется внутримолекулярным, но по своей природе аналогично межмолекулярным взаимодействиям.
Все межмолекулярные взаимодействия имеют в основе электрическую природу, согласно которой разноименные заряды притягиваются, а одноименные отталкиваются. За счет межмолекулярных связей из отдельных частиц образуются ассоциаты, которые частично или полностью разрушаются при переходе вещества из твердого агрегатного состояния в жидкое или газообразное. В зависимости от природы взаимодействующих частиц различают следующие типы межмолекулярных (межчастичных) взаимодействий: ион-ионные, ион-диполъные, ориентационные (диполь-дипольные), индукционные (ион или диполь -индуцированный диполь), дисперсионные (мгновенный диполь -индуцированный мгновенный диполь), гидрофобные взаимодействия и водородные связи.
Ион-ионное взаимодействие характерно при наличии в системе противоположно заряженных ионов и наблюдается не только для веществ с ионной кристаллической решеткой, но также в белках и нуклеиновых кислотах. В белках ионизированные группы —NH3+ и —СОO- взаимодействуют между собой. Карбоксильные группы —СОО- белков и фосфатные группы (RO)2POO- нуклеиновых кислот взаимодействуют с катионами металлов.
В организме (in vivo) молекулы белков и нуклеиновых кислот благодаря ион-ионным взаимодействиям образуют с биосубстратами ассоциаты различной устойчивости. Кроме того, эти взаимодействия участвуют в стабилизации определенных конформаций биомолекул. Ион-ионные взаимодействия молекул белков или нуклеиновых кислот с катионами металлов могут приводить к возникновению ковалентных связей с образованием комплексных соединений различной устойчивости (разд. 10.4). Поэтому энергия ион-ионных взаимодействий колеблется в широких пределах: 160-460 кДж/моль (табл. 3.1).
Энергия ион-ионных взаимодействий зависит от зарядов ионов (е1 и е2) и расстояния между их центрами (r) по закону е1е2/r, т. е. она увеличивается с ростом зарядов ионов и уменьшением их радиусов. Поэтому сила взаимодействия анионов нуклеиновых кислот с катионами Na+, К+, Mg2+, Са2+ максимальна в случае катиона магния, играющего большую роль в активации нуклеиновых кислот в клетке.
Ион-дипольное взаимодействие. Этот вид взаимодействия наблюдается между ионом и полярной молекулой или полярной группой, обладающими постоянным дипольным моментом. Когда ион взаимодействует с диполем, то к нему притягивается полюс диполя, несущий заряд, противоположный по знаку заряду иона (табл. 3.1). Энергия ион-дипольных взаимодействий зависит от заряда иона (e1), дипольного момента постоянного диполя ( ) и расстояния между центром иона и серединой диполя (г) по закону e1
) и расстояния между центром иона и серединой диполя (г) по закону e1  /r2- Ион-дипольные силы играют особо важную роль в водных растворах электролитов: диссоциация молекул электролитов на ионы обеспечивается взаимодействием образующихся ионов с полярными молекулами воды, т. е. их гидратацией (разд. 6.1). При этом в случае таких катионов "металлов жизни", как Mg2+ и Са2+, образуются достаточно устойчивые гидраты, например [Са(Н20)б]2+, которые рассматриваются как аквакомплексы (разд. 10.2). Следовательно, ион-дипольное взаимодействие, так же как и ион-ионное, может приводить к возникновению ковалентной связи между реагирующими частицами. Именно эти два вида взаимодействий часто лежат в основе образования ассоциатов: фермент - кофермент, фермент - субстрат и антиген - антитело, играющих важную роль в жизнедеятельности организмов.
/r2- Ион-дипольные силы играют особо важную роль в водных растворах электролитов: диссоциация молекул электролитов на ионы обеспечивается взаимодействием образующихся ионов с полярными молекулами воды, т. е. их гидратацией (разд. 6.1). При этом в случае таких катионов "металлов жизни", как Mg2+ и Са2+, образуются достаточно устойчивые гидраты, например [Са(Н20)б]2+, которые рассматриваются как аквакомплексы (разд. 10.2). Следовательно, ион-дипольное взаимодействие, так же как и ион-ионное, может приводить к возникновению ковалентной связи между реагирующими частицами. Именно эти два вида взаимодействий часто лежат в основе образования ассоциатов: фермент - кофермент, фермент - субстрат и антиген - антитело, играющих важную роль в жизнедеятельности организмов.
Вещества, имеющие ионную кристаллическую решетку, состоящую из однозарядных ионов, за редким исключением, легко растворимы в воде, так как энергия гидратации этих ионов выше энергии кристаллической решетки. Напротив, многозарядные ионы в кристаллической решетке часто взаимодействуют друг с другом настолько сильно, что энергия решетки выше энергии гидратации. Поэтому такие соли, как CaC03, BaS04, А1Р04, практически нерастворимы в воде.
Ориентационное взаимодействие. Этот вид взаимодействия наблюдается между полярными молекулами, обладающими постоянным дипольным моментом. Полярные молекулы взаимно ориентируются таким образом, что отрицательный полюс одного диполя располагается вблизи положительного полюса другого диполя, что обеспечивает их взаимное притяжение (табл. 3.1). В результате ориентационного взаимодействия диполи устанавливаются в линию разноименными полюсами друг к другу или ориентируются антипараллельно.
Энергия ориентационного взаимодействия двух диполей зависит от их дипольных моментов ( 1 и
1 и  ) и от расстояния (r) между центрами диполей по закону
) и от расстояния (r) между центрами диполей по закону  /r6. Следовательно, ориентационное взаимодействие существенно только между полярными молекулами, находящимися в непосредственной близости друг к другу, причем энергия этого взаимодействия очень сильно зависит от величины дипольного момента. Так, температура кипения органических жидкостей с приблизительно одинаковой молекулярной массой сильно возрастает при увеличении дипольного момента (табл. 3.2).
/r6. Следовательно, ориентационное взаимодействие существенно только между полярными молекулами, находящимися в непосредственной близости друг к другу, причем энергия этого взаимодействия очень сильно зависит от величины дипольного момента. Так, температура кипения органических жидкостей с приблизительно одинаковой молекулярной массой сильно возрастает при увеличении дипольного момента (табл. 3.2).
Таблица 3.2
 |
Молекулярные массы, дипольные моменты и температуры кипения органических соединений
 |
Ориентационное взаимодействие значительно слабее, чем ион-дипольное (табл. 3.1).
Индукционное взаимодействие наблюдается между неполярной молекулой и ионом или молекулой с постоянным диполем. Под действием электрического поля последних электронное облако неполярной молекулы деформируется, т. е. в ней индуцируется диполь (табл. 3.1). Наиболее склонны к индукционному взаимодействию легкополяризуемые неполярные молекулы. Примером индукционного взаимодействия является растворимость неполярных, но легко поляризуемых молекул иода I2 в воде и значительное повышение растворимости иода в присутствии аниона I вследствие взаимодействия I- + I2 = I3- с образованием комплексного иона I3- (I2 • I-), который хорошо растворяется в воде. В результате индукционного взаимодействия иод образует комплексы характерного синего цвета с крахмалом или поливиниловым спиртом, молекулы которых содержат много полярных групп —ОН (разд. 22.3).
Энергия индукционного взаимодействия неполярной молекулы с ионом меняется по закону 1/r4, а с диполем - по закону 1/r6. Индукционное взаимодействие обычно слабее ориентационного.
Дисперсионные взаимодействия. Это взаимодействие мгновенный диполь - индуцированный мгновенный диполь. Оно является самым слабым изо всех видов межмолекулярных взаимодействий, но в то же время наиболее универсальным. В чистом виде проявляется при взаимодействии неполярных молекул. Постоянное движение электронов в молекуле, а также колебание ядер вызывают появление в молекуле мгновенного диполя, под действием которого в соседней молекуле индуцируется также мгновенный диполь (табл. 3.1). Флюктуации электронных плотностей в молекуле или атоме происходят непрерывно, а их результирующим эффектом является слабое, но важное по своему значению взаимное притяжение этих частиц. Энергия дисперсионного взаимодействия меняется по закону 1/r6.
Дисперсионные взаимодействия обычно тем сильнее, чем больше размеры атомов и молекул по той причине, что внешние электроны в них удерживаются менее прочно. Это способствует появлению более сильных мгновенных диполей. Так, за счет дисперсионных взаимодействий газообразные вещества, молекулы которых неполярны, переходят в жидкое и твердое состояние только при очень низких температурах:
 |
В случае длинных линейных молекул может возникать много мгновенных диполей в каждой точке соприкосновения с соседней молекулой. Поэтому в ряду линейных алканов общей формулы CnН2n+2 по мере увеличения nзакономерно повышаются их температуры плавления и кипения (рис. 3.1).
Температура кипения алканов с разветвленной цепью всегда ниже, чем прямоцепочечных. Так, температуры кипения н-гептана и его разветвленного изомера 2,2,3-триметилбутана равны соответственно +98 и +81 °С. Это объясняется большей компактностью, а следовательно, меньшей поверхностью молекулы в последнем случае.
 |
Ориентационные, индукционные и дисперсионные взаимодействия между нейтральными частицами принято в целом называть вандерваальсовыми силами притяжения, так как представление о них впервые было введено голландским ученым Я. Д. Вандер-Ваальсом. Наиболее важной и отличительной чертой этих сил является универсальность, так как они действуют между любыми нейтральными частицами без исключения. Эти взаимодействия проявляются на расстояниях 400-600 пм, и их энергия сильно уменьшается с увеличением этого расстояния. Кроме того, им не свойственна насыщаемость.
Рис. 3.1. Зависимость температур плавления и кипения линейных углеводородов CnН2n+2 от длины углеродной цепи (л)
Водородная связь. Специфической разновидностью межмолекулярных взаимодействий является водородная связь. Уже из названия этой связи ясно, что в ее образовании принимает участие входящий в состав молекулы атом водорода. Данная связь возникает в тех случаях, когда атом водорода связан ко-валентной связью с сильно электроотрицательным атомом, что создает частичный положительный заряд на атоме водорода. Поэтому водородная связь характерна для соединений, содержащих сильнополярные ковалентные связи: Н—F; О—Н; N—Н. Водородная связь возникает между атомом водорода одной молекулы, несущим частичный положительный заряд -  , и электроотрицательным атомом другой молекулы, несущим частичный отрицательный заряд и содержащим неподеленную электронную пару:
, и электроотрицательным атомом другой молекулы, несущим частичный отрицательный заряд и содержащим неподеленную электронную пару:  ,. Водородная связь схематично изображается пунктиром:
,. Водородная связь схематично изображается пунктиром:  (табл. 3.1).
(табл. 3.1).
Рассмотрим образование водородной связи на конкретном примере. В молекуле воды связи 0-Н сильно полярны, при этом на атомах водорода имеется частичный положительный заряд  +, а на атоме кислорода - отрицательный заряд
+, а на атоме кислорода - отрицательный заряд  и, кроме того, у него есть две неподеленные электронные пары. Это способствует образованию молекулой воды четырех водородных связей с соседними молекулами воды. При этом каждая молекула воды в двух водородных связях выступает донором двух своих атомов водорода, несущих частичный положительный заряд, а в двух других - донором двух неподеленных электронных пар своего атома кислорода. В результате молекулы воды образуют межмолекулярные ассоциаты, обладающие трехмерной сетчатой структурой. За счет
и, кроме того, у него есть две неподеленные электронные пары. Это способствует образованию молекулой воды четырех водородных связей с соседними молекулами воды. При этом каждая молекула воды в двух водородных связях выступает донором двух своих атомов водорода, несущих частичный положительный заряд, а в двух других - донором двух неподеленных электронных пар своего атома кислорода. В результате молекулы воды образуют межмолекулярные ассоциаты, обладающие трехмерной сетчатой структурой. За счет
 |
водородной связи происходит межмолекулярная ассоциация фтороводорода, аммиака,
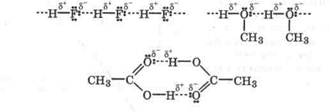 |
спиртов, карбоновых кислот:
Наличие межмолекулярных водородных связей отражается на физических свойствах веществ (температуры плавления и кипения, вязкость, плотность, растворимость). Именно водородными связями объясняются аномалии в свойствах воды: высокие температуры плавления и кипения, большая плотность и вязкость, способность образовывать кристаллогидраты.
Энергия водородной связи (10-40 кДж/моль) меньше, чем ковалентной, ионной или металлической, но больше, чем энергия вандерваальсовых взаимодействий. В соответствии с электроотрицательностью элементов наиболее сильные водородные связи образуются с участием атома фтора, более слабые - с участием атома кислорода, еще более слабые - с участием атома азота. Длина водородной связи  , определяемая как расстояние между атомами X и Y, составляет 220-350 пм.
, определяемая как расстояние между атомами X и Y, составляет 220-350 пм.
Водородные связи могут возникать не только между различными молекулами, но и внутри молекулы, если в этой молекуле имеются протонодонорные (—ХН) и протоноакцепторные (:Y—) группы. Например, в молекуле салицилового альдегида имеется внутримолекулярная водородная связь между атомом водорода гидроксильной группы и атомом кислорода карбонильной группы. Соединения с внутримолекулярной водородной связью, как правило, имеют пониженные температуры плавления и кипения и меньшую вязкость в жидком состоянии, так как их молекулы меньше ассоциированы с соседними молекулами.
Молекулы белков, нуклеиновых кислот и полисахаридов содержат много протонодонорных  и протоно-акцепторных
и протоно-акцепторных  групп, склонных к образованию множества водородных мостиков между отдельными участками одной молекулы или между разными молекулами. В результате макромолекулы этих биополимеров приобретают определенную пространственную структуру, обеспечивающую их биологические функции (разд. 21.4, 22.3, 23.3). Разрыв водородных связей приводит к существенному изменению пространственной структуры макромолекул и их биохимических свойств.
групп, склонных к образованию множества водородных мостиков между отдельными участками одной молекулы или между разными молекулами. В результате макромолекулы этих биополимеров приобретают определенную пространственную структуру, обеспечивающую их биологические функции (разд. 21.4, 22.3, 23.3). Разрыв водородных связей приводит к существенному изменению пространственной структуры макромолекул и их биохимических свойств.
 |
Относительно низкая энергия водородной связи (в некоторых случаях сравнимая с энергией теплового движения) позволяет ей легко разрушаться и восстанавливаться при обычных условиях, что обусловливает ту огромную роль, которую играет эта связь в биологических системах. Почти все биохимические процессы на тех или иных стадиях сопровождаются образованием или разрушением водородных связей.
Гидрофобные взаимодействия. Этот вид взаимодействия основан не на притяжении, а на отталкивании гидрофобными (неполярными) группами или неполярными молекулами близко расположенных полярных молекул воды. В результате воздействия этих сил происходит выталкивание молекул воды из пространства между гидрофобными фрагментами, что способствует их дисперсионному взаимодействию между собой и структурированию соседних молекул воды гидратной оболочки с формированием в ней энергетически выгодной структуры (разд. 6.1). Таким образом, гидрофобные взаимодействия повышают упорядоченность расположения частиц в системе, т. е. уменьшают энтропию системы (разд. 4.3). Гидрофобные взаимодействия играют важную роль при формировании мицелл поверхностно-активных веществ в растворах и глобул из белков, а также в свойствах биологических мембран и мембранных белков. К сожалению, довольно часто термин "гидрофобные взаимодействия" используют неправильно, так как пытаются отразить им взаимное притяжение неполярных (гидрофобных) групп между собой, которое в действительности всегда имеет дисперсионный характер.
Итак, все межмолекулярные взаимодействия способствуют образованию различных видов ассоциатов из взаимодействующих частиц. При этом нужно понимать, что не только физические и химические свойства, но особенно биологические и физиологические функции этих ассоциатов могут значительно отличаться от свойств образовавших их частиц. Межмолекулярные взаимодействия лежат в основе процессов сорбции и десорбции (разд. 26.2), образования и разрушения различных видов мицелл (разд. 27.2, 27.3), формирования в водной среде определенной пространственной структуры белков, нуклеиновых кислот и полисахаридов, а также аналогичных процессов, протекающих внутри межклеточных мембран (разд. 27.7.1). Слабые межмолекулярные взаимодействия с энергией менее 20 кДж/моль ответственны за молекулярную гибкость и молекулярное узнавание, реализуемое в ферментативном катализе (разд. 5.6), а также в целом ряде биологических процессов, проходящих на молекулярном уровне. Кроме того, межмолекулярные взаимодействия ответственны за агрегатное состояние вещества и его превращения при изменении внешних условий, чему посвящен следующий раздел.
Дата публикования: 2014-10-16; Прочитано: 12783 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
