 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Механизмы возникновения ковалентной связи
|
|
Ковалентная связь, в зависимости от того, как возникает общая электронная пара, может образовываться по обменному или донорно-акцепторному механизму (см. табл. 2.1).
 |  | ||
Обменный механизм. При обменном механизме в образовании общей электронной пары от каждого атома участвуют и атомная орбиталь, и неспаренный электрон, находящийся на этой орбитали. По обменному механизму ковалентная связь возникает, например, в молекуле водорода H2.Взаимодействующие атомы водорода, содержащие на атомных s-орбиталях одиночные электроны с противоположными спинами, образуют общую электронную пару, движение которой в молекуле описывается
 -молекулярной орбиталью, возникающей при слиянии s-атомных орбиталей:
-молекулярной орбиталью, возникающей при слиянии s-атомных орбиталей:
В молекуле аммиака NH3 атом азота, имея на атомных орбиталях внешнего уровня три одиночных электрона и одну электронную пару, образует с участием s-электронов трех атомов водорода три общие электронные пары. Эти общие электронные пары в молекуле находятся на  -молекулярных орбиталях, возникающих в результате слияния каждой атомной орбитали атома азота с s-орбиталью атома водорода:
-молекулярных орбиталях, возникающих в результате слияния каждой атомной орбитали атома азота с s-орбиталью атома водорода:
Донорно-акцепторный механизм. Донорно-акцепторныи механизм возникновения ковалентной связи наблюдается в тех случаях, когда один компонент (донор) имеет на атомной орбитали внешнего уровня электронную пару, а другой (акцептор) - свободную орбиталь. При слиянии атомных орбиталей возникает молекулярная орбиталь, на которой находится общая электронная пара, ранее принадлежавшая донору. Схему этого механизма можно представить так:

|
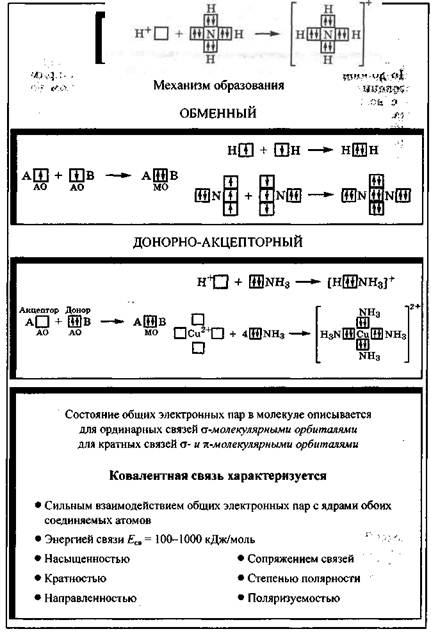 |
По донорно-акцепторному механизму происходит, например, образование связи между молекулой аммиака и катионом водорода с возникновением иона аммония [NH4]+. В молекуле аммиака у атома азота во внешнем слое имеется свободная электронная пара, что позволяет этой молекуле выступать в роли донора. У катиона водорода имеется свободная 1s-орбиталь. За счет слияния атомных орбиталей атома азота и катиона водорода возникает
 -молекулярная орбиталь, а свободная пара электронов атома азота становится общей для соединяющихся атомов:
-молекулярная орбиталь, а свободная пара электронов атома азота становится общей для соединяющихся атомов:
В ионе NH4 ковалентная связь N—Н, образовавшаяся по донорно-акцепторному механизму, полностью эквивалентна по энергии и длине трем другим ковалентным связям N—Н, возникшим по обменному механизму.
 |
Связь, образованную по донорно-акцепторному механизму, часто называют донорно-акцепторной, координационной или координативной связью. Однако это не особый вид связи, а лишь иной механизм образования ковалентной связи. Донорно-акцепторный механизм возникновения ковалентной связи характерен для комплексных соединений: роль акцептора обычно выполняют катионы металлов, предоставляющие свободные атомные орбитали, например Сu2+, который предоставляет четыре свободные атомные орбитали, а донором электронных пар могут быть, например, четыре молекулы NH3 или четыре аниона CN-:
В обоих случаях между донором и акцептором возникают ковалентные связи с образованием комплексного катиона или аниона.
Дата публикования: 2014-10-16; Прочитано: 2664 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
