 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Относительная электроотрицательность
|
|
Удобной величиной для характеристики способности атома элемента притягивать к себе общие электроны в молекуле является электроотрицательность.
Относительной электроотрицательностью СОЭО)
атома элемента называют величину, характеризующую относительную способность атома элемента притягивать к себе общие электроны в молекуле.
За единицу 0Э0 принята электроотрицательность атома лития, у фтора этот показатель равен 4,0. Относительно данных величин рассматриваются электроотрицательности остальных элементов (табл. 1.3).
У элементов в пределах периода с увеличением заряда атомного ядра наблюдается увеличение ОЭО: наименьшие значения характерны для элементов группы I A, т. е. щелочных металлов, а наибольшие - для галогенов, элементов группы VIIA. В соответствии с этим элементы становятся все более слабыми восстановителями и все более сильными окислителями. Самые сильные окислители в периоде - элементы группы VII A.
Внутри группы электроотрицательность элементов уменьшается сверху вниз. Чем выше электроотрицательность, тем сильнее выражены у элемента неметаллические свойства и окислительная способность, а при малой электроотрицательности элемент обладает металлическими свойствами и высокой восстановительной способностью. Таким образом, самым сильным окислителем является фтор 9F (группа VIIA), а самым сильным восстановителем - франций 87Fr (группа IA). Разность ОЭО соседних атомов в соединениях позволяет судить о полярности химической связи между ними (см. разд. 2.1.3).
Периодичность в свойствах элементов, связанная с изменением строения электронных оболочек при возрастании заряда ядра их атомов, наблюдается и для однотипных соединений. В периоде слева направо основные свойства оксидов и гидроксидов групп IA, 2А постепенно сменяются амфотерными и для соединений элементов групп VA-VIIA становятся кислотными. В группах А, кроме VIII, сверху вниз усиливается основный характер оксидов и гидроксидов, а их кислотные свойства ослабевают. Например: CsOH - более сильное основание, чем LiOH, а кислота НР03 значительно слабее, чем HN03. В то же время для водных растворов бинарных соединений неметаллов с водородом типа HF, НСl, НВг, HI или Н20, H2S, H2Se, Н2Те кислотные свойства возрастают от HF к HI, а также от Н20 к Н2Те.
Для оксидов и гидроксидов элементов, ОЭО которых находится в интервале 1,5-2,2, обычно характерны амфотерные свойства, при этом чем меньше значение ОЭО, тем больше проявляются основные свойства их оксидов и гидроксидов. По мере увеличения ОЭО элементов возрастает кислотность их оксидов и гидроксидов. Для галлия 31Ga (ОЭО = 1,82) кислотные и основные свойства его оксида Ga203 и гидроксида Ga(OH)3 выражены в одинаковой степени.
|
Глава 2 ХИМИЧЕСКАЯ СВЯЗЬ
После изучения этой главы вы должны:
- понимать природу и знать характерные свойства ковалентной, ионной и металлической связи;
- знать основные типы молекулярных ореиталей:
- механизмы возникновения ковалентныхсвязей;
- особенности ковалентной связи (краткость, насыщаемость, направленность, сопряжение связей, полярнссть, поляризуемость);
- иметь представление о влиянии, которое оказывает гибридизация атомных орбиталей на пространственную структуру молекул и ионов;
- знать, в каких системах имеет место сопряжение связей, что такое ароматические соединения;
- иметь понятие о поляризуемости атомов, молекул и ионов и подразделении их на "жесткие" и "мягкие";
- знать особенности ионной и металлической связи.
В природе элементы в виде изолированных атомов практически не встречаются. Обычно атомы элемента взаимодействуют либо друг с другом, либо с атомами других элементов, образуя химические связи с возникновением молекул. В то же время и молекулы вещества взаимодействуют друг с другом.
Химическая связь - это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые структуры.
Сущность природы химической связи была объяснена лишь после открытия законов квантововолновой механики, управляющих микромиром. Современная теория отвечает на вопросы: почему возникает химическая связь и какова природа сил, обусловливающих ее?
Возникновение химических связей - процесс самопроизвольный, в противном случае в природе не существовало бы сложных молекул белков и нуклеиновых кислот. С точки зрения термодинамики (разд. 4.3, 4.4) причиной образования химической связи между частицами является уменьшение энергии системы. Следовательно, образование химической связи всегда сопровождается выделением энергии, а разрыв химической связи всегда требует затраты энергии.
Энергия связи — энергия, выделяющаяся в процессе образования связи и характеризующая прочность этой связи (Есв, кДж/моль).
В зависимости от типа соединяемых частиц различают внутримолекулярные связи, за счет которых образуются молекулы, и межмолекулярные связи, приводящие к образованию ассоциатов из молекул или к связыванию отдельных групп в молекуле биополимера, что обеспечивает ее конформацию (разд. 3.1). Эти виды связей резко отличаются по величине энергии: для внутримолекулярных связей энергия составляет 100-1000 кДж/моль, а энергия межмолекулярных связей обычно не превышает 40 кДж/моль. Рассмотрим образование и типы внутримолекулярной химической связи.
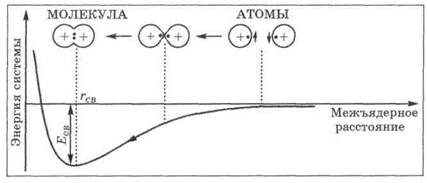
Согласно современным представлениям при сближении атомов между их внешними электронами с противоположными спинами происходит сильное обменное взаимодействие, приводящее к появлению общей электронной пары. При этом возрастает электронная плотность в межъядерном пространстве, что способствует притяжению ядер взаимодействующих атомов (см. рис. на стр. 31). В результате энергия системы уменьшается и между атомами возникает химическая связь. В зависимости от того, каким образом взаимодействует общая электронная пара с ядрами соединяемых атомов, различают три вида химической связи: ковалентную, ионную и металлическую.
Дата публикования: 2014-10-16; Прочитано: 8006 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
