 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ковалентная связь
|
|
Слово "ковалентная" буквально означает "объединенная".
Химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью.
Ковалентная связь образуется между атомами элементов, электроотрицательности которых одинаковы или различаются не слишком сильно. Например, связь в молекулах: Н2, F2, HF, СН4, С2Н4, С02, H2S, Н20, S02, NH3.
2.1.1.  и
и  МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
При образовании ковалентной связи за счет слияния атомных орбиталей (АО) взаимодействующих атомов возникает единая молекулярная орбиталь (МО). Отличие молекулярной орбитали от атомной заключается в том, что она охватывает оба ядра соединяемых атомов. В то же время, как и на атомной, на молекулярной орбитали может находиться не более двух электронов и спины их должны быть противоположны. В случае ковалентной связи электронная плотность между ядрами соединяемых атомов значительна. Это является следствием сильного взаимодействия общей электронной пары с ядрами обоих соединяемых атомов.
В зависимости от характера распределения электронной плотности в молекуле различают  и
и  молекулярные орбитали (рис. 2.1).
молекулярные орбитали (рис. 2.1).
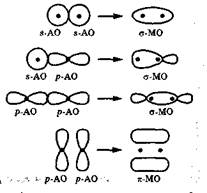
Молекулярная орбиталь, в которой максимальная электронная плотность сосредоточена на прямой, соединяющей ядра атомов, называется  -молекулярной орбиталъю (
-молекулярной орбиталъю (  -МО).
-МО).
Такого типа молекулярная орбиталь образуется при слиянии двух s-атомных орбиталей (молекула Н2), s-орбитали и р- орбитали (молекула HF) или двух р-орбиталей, которые перекрываются по оси симметрии (молекула F2). Когда ковалентная связь возникает с участием гибридных атомных орбиталей (связи С—Н и С—С в молекуле С2Нб), то всегда образуется  - молекулярная орбиталь. Ковалентную связь, при которой движение общей электронной пары описывается а
- молекулярная орбиталь. Ковалентную связь, при которой движение общей электронной пары описывается а  -молекулярной орбиталью, называют
-молекулярной орбиталью, называют  -связью. Между двумя атомами в молекуле может быть только одна
-связью. Между двумя атомами в молекуле может быть только одна  -связь.
-связь.
Молекулярная орбиталь, возникающая в результате бокового перекрывания р-орбиталей взаимодействующих атомов, так что ее максимальная электронная плотность сосредоточена вне прямой, соединяющей ядра этих атомов, называется  молекулярной орбиталью (
молекулярной орбиталью (  -МО).
-МО).
 |
Ковалентную связь, при которой движение общей электронной пары описывается
 -молекулярной орбиталью, называют
-молекулярной орбиталью, называют  -связью. Образование
-связью. Образование  -связи между двумя атомами происходит только в том случае, если эти атомы уже соединены о-связью, что имеет место, например, в молекуле этилена (рис. 2.2). Между двумя атомами в молекуле совместно с одной
-связи между двумя атомами происходит только в том случае, если эти атомы уже соединены о-связью, что имеет место, например, в молекуле этилена (рис. 2.2). Между двумя атомами в молекуле совместно с одной  - связью могут быть одна или две
- связью могут быть одна или две  -связи:
-связи:
Рис. 2.2. Образование π-молекулярной орбитали в молекуле этилена (Н2С=СН2)

|
Общая электронная пара, находящаяся на  -молекулярной орбитали, из-за большого удаления от ядер соединяемых
-молекулярной орбитали, из-за большого удаления от ядер соединяемых
атомов слабее взаимодействует с ними, чем в случае  -молекулярной орбитали. Поэтому в соединениях реакционная способность π-связи всегда больше, чем
-молекулярной орбитали. Поэтому в соединениях реакционная способность π-связи всегда больше, чем  -связи.
-связи.

|

|

|

|

|

|
Дата публикования: 2014-10-16; Прочитано: 1729 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
