 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задача №20
|
|
Оцените влияние температуры и давления на константу равновесия реакции, приведенной в табл. 2. Тепловой эффект реакции взять из решения задачи №2.
Решение:
Решение задачи рассмотрим на примере реакции синтеза аммиака 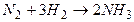 .
.
а) Для оценки влияния температуры воспользуемся уравнением изобары Вант–Гоффа (61).
Анализ уравнения изобары Вант-Гоффа показывает, что характер зависимости константы равновесия 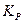 от температуры определяется знаком теплового эффекта
от температуры определяется знаком теплового эффекта 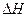 . Возможны 3 случая:
. Возможны 3 случая:
1) 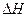 > 0 – для эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Отсюда
> 0 – для эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Отсюда 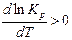 , зависимость константы равновесия от температуры будет возрастающей, т.е. с ростом температуры константа равновесия
, зависимость константы равновесия от температуры будет возрастающей, т.е. с ростом температуры константа равновесия 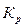 будет увеличиваться.
будет увеличиваться.
2) 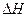 < 0 – для экзотермических реакций, т.е. реакций, протекающих с выделением теплоты. Отсюда
< 0 – для экзотермических реакций, т.е. реакций, протекающих с выделением теплоты. Отсюда 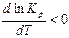 , зависимость константы равновесия от температуры будет убывающей, т.е. с ростом температуры константа равновесия
, зависимость константы равновесия от температуры будет убывающей, т.е. с ростом температуры константа равновесия 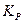 будет уменьшаться.
будет уменьшаться.
3) Если 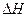 » 0, то
» 0, то 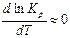 , следовательно, константа равновесия от температуры не зависит.
, следовательно, константа равновесия от температуры не зависит.
Для рассматриваемой реакции 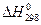 = –91,88 кДж, т.е. реакция является экзотермической, следовательно, выполняется условие (2). Поэтому с ростом температуры константа равновесия будет уменьшаться. Это согласуется с величинами констант равновесия при температурах Т = 298 К и Т = 800 К (см. решение задачи № 18).
= –91,88 кДж, т.е. реакция является экзотермической, следовательно, выполняется условие (2). Поэтому с ростом температуры константа равновесия будет уменьшаться. Это согласуется с величинами констант равновесия при температурах Т = 298 К и Т = 800 К (см. решение задачи № 18).
б) Для оценки влияния давления воспользуемся уравнением Планка:
 , (64),
, (64),
где 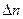 – изменение числа молей газообразных веществ в ходе реакции. Проанализируем уравнение Планка:
– изменение числа молей газообразных веществ в ходе реакции. Проанализируем уравнение Планка:
1) Если реакция идет с увеличением числа молей газообразных веществ, 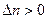 , то
, то 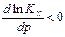 , т.е. с ростом давления константа равновесия
, т.е. с ростом давления константа равновесия 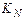 уменьшается.
уменьшается.
[1] Для органических веществ уравнение зависимости теплоемкости от температуры Ср = а + bT + cT2, для неорганических Ср = а + bT + c//T2.
Дата публикования: 2014-11-18; Прочитано: 274 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
