 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задача №15
|
|
Запишите выражения для констант равновесия KC, Kр и KN и установите связь между ними для реакции, приведенной в табл. 2.
Решение:
Решение задачи рассмотрим на примере реакции 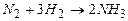 , считая реагирующие вещества идеальными газами.
, считая реагирующие вещества идеальными газами.
В условиях равновесия при р, T = const схематическая запись химической реакции имеет вид:
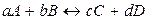 ,
,
где a, b, c, d – стехиометрические коэффициенты веществ A, B, C, D. Для рассматриваемой реакции закон действующих масс устанавливает постоянство отношения произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам, то есть
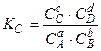 .
.
На основании закона действующих масс запишем выражение для константы равновесия KC для реакции синтеза аммиака.
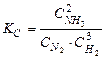 .
.
Аналогичным образом записываются формулы для констант равновесия, выраженных через равновесные парциальные давления:
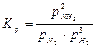
и равновесные мольные доли:
 .
.
Связь между Kр и KC устанавливается на основании уравнения (9). Для i-го компонента газовой смеси 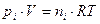 , отсюда:
, отсюда: 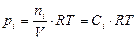 . На основании данного выражения
. На основании данного выражения
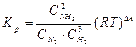 .
.
Для реакции синтеза аммиака Dn = (2) – (1 + 3) = – 2. Следовательно,
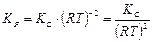 .
.
Связь между Kр и KN устанавливается на основании закона Дальтона: 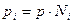 , где р – общее давление в системе. Оперируя данным выражением, получим
, где р – общее давление в системе. Оперируя данным выражением, получим
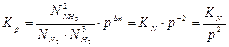 .
.
Необходимо отметить, что при расчете констант всегда используется безразмерное относительное давление, равное отношению давления к стандартному значению р о = 1 атм = 1,01325∙105 Па.
Дата публикования: 2014-11-18; Прочитано: 342 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
