 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задача №16
|
|
Для реакции, приведенной в табл. 2, рассчитайте константы равновесия Kр, KC и KN при 298 К и общем давлении р Па (табл.15). Выразите константу равновесия Kр через состав равновесной смеси, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении.
Таблица 15
| Вариант | р ·10–6, Па | Вариант | р ·10–6, Па |
| 9,73 | 9,76 | ||
| 9,74 | 9,78 | ||
| 9,75 | 9,79 | ||
| 9,73 | 9,73 | ||
| 9,73 | 9,73 | ||
| 9,73 | 9,79 | ||
| 9,74 | 9,74 | ||
| 9,77 | 9,75 | ||
| 9,78 | 9,73 | ||
| 9,73 | 9,71 | ||
| 9,77 | 9,77 | ||
| 9,77 | 9,75 | ||
| 9,78 | 9,78 | ||
| 9,79 | 9,77 | ||
| 9,76 | 9,76 |
Решение:
Решение задачи рассмотрим на примере реакции 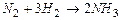 . Рассчитаем константы равновесия KN, KC и Kр при Т = 298 К и общем давлении 9,73·106Па, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении (1 моль N2 и 3 моль H2).
. Рассчитаем константы равновесия KN, KC и Kр при Т = 298 К и общем давлении 9,73·106Па, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении (1 моль N2 и 3 моль H2).
Значение константы равновесия при температуре 298 К найдем из соотношения
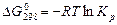 .
.
Отсюда
 .
.
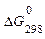 = –32953,5 Дж (см. задачу №13).
= –32953,5 Дж (см. задачу №13).
 .
.
Соотношения между KC, Kр и KN выведены в задаче 15:
 ,
,
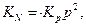
где р – относительное давление, т.е. давление, отнесенное к стандартному: р = 9,73·106 / 1,01325∙105 = 96.
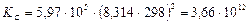 ,
,
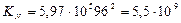 .
.
Для расчета состава равновесной смеси определим количество молей в состоянии равновесия.
Обозначим через х число молей NH3 в момент равновесия. На основании стехиометрии реакции, если образовалось две молекулы NH3, то израсходована одна молекула азота и три молекулы водорода. Таким образом, если образовалось х молей NH3, то израсходовано  молей N2 и
молей N2 и 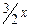 молей H2. По условию задачи для проведения реакции взяты 1 моль N2 и 3 моль H2. Следовательно, к моменту равновесия в реакционной смеси осталось
молей H2. По условию задачи для проведения реакции взяты 1 моль N2 и 3 моль H2. Следовательно, к моменту равновесия в реакционной смеси осталось  молей N2 и
молей N2 и 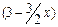 молей H2 .
молей H2 .
Рассчитаем общее число молей компонентов реакции в момент равновесия
 .
.
Определим мольную долю каждого компонента реакции при равновесии по формуле (41). Определим также равновесное парциальное давление компонентов на основании закона Дальтона (табл.16).
Таблица 16
| Вещество | N2 | H2 | NH3 | |
| Число молей | В начале реакции | y | 3y | – |
| В момент равновесия | 
| 
| 
| |
| Мольная доля компонента | 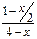
| 
| 
| |
| Равновесное парциальное давление | 
| 
| 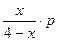
|
Выражение для константы равновесия имеет вид:

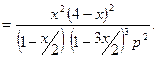
Дата публикования: 2014-11-18; Прочитано: 400 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
