 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задача №11. Рассчитайте изменение энтропии при смешении n1 моль газа 1 и n2 моль газа 2 при постоянной температуре и давлении 1 атм (табл
|
|
Рассчитайте изменение энтропии при смешении n1 моль газа 1 и n2 моль газа 2 при постоянной температуре и давлении 1 атм (табл. 12). Принять, что данные вещества подчиняются законам идеальных газов.
Таблица 12
| Вариант | Газ 1 | Газ 2 | n1, моль | n2 , моль |
| H2 | N2 | |||
| H2O | O2 | |||
| He | CO2 | |||
| CH4 | C2H6 | |||
| Ne | CH4 | 2,5 | ||
| H2 | He | |||
| CO | C2H4 | 3,5 | ||
| CO2 | N2 | |||
| CH4 | CO2 | |||
| C2H6 | Xe | |||
| CH4 | C2H4 | |||
| CO | CO2 | |||
| N2 | Cl2 | |||
| H2O | N2 | |||
| He | O2 | |||
| N2 | O2 | |||
| F2 | Ar | |||
| Ne | Cl2 | |||
| Kr | CO2 | |||
| Ar | Cl2 | |||
| O2 | H2 | |||
| Cl2 | N2 | |||
| CO | Kr | 1,5 | ||
| Ar | Ne | 4,5 | ||
| Xe | F2 | 2,5 | ||
| C2H4 | Kr | 3,5 | 4,5 | |
| CO2 | F2 | 1,8 | ||
| C2H4 | Ne | 7,5 | ||
| CH4 | Ar | 4,5 | ||
| Kr | Cl2 | 8,5 |
Решение:
Рассчитаем изменение энтропии при смешении двух молей азота (газ 1) и трех молей водорода (газ 2) при постоянной температуре и давлении 1 атм.
В случае смешения идеальных газов процесс можно представлять как изотермическое расширение каждого из газов до общего объема. При изотермическом расширении
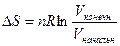 , (39)
, (39)
где n – число молей газа, Vначальн – начальный объем газа, Vконечн – конечный объем, который в данном случае (при р = const) равен сумме начальных объемов обоих газов.
Для газа 1
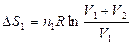 ,
,
так же можно выразить DS2. Следовательно,
DSсмеш = DS1 + DS2 =  . (40)
. (40)
Парциальный объем идеального газа пропорционален его мольной доле в смеси. Мольная доля газа в смеси рассчитывается по формуле:
 . (41)
. (41)
Выразим мольную долю газа 1 в смеси
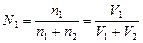 ,
,
и газа 2 –
 ,
,
Тогда изменение энтропии при смешении двух газов можно рассчитать по формуле
DSсмеш = –R (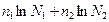 ) (42)
) (42)
DSсмеш = –8,314( ) = 27,98 Дж/К.
) = 27,98 Дж/К.
Так как ∆S>0 процесс смешения газов протекает самопроизвольно.
Дата публикования: 2014-11-18; Прочитано: 1819 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
