 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задача №14
|
|
Вычислите изменение энергии Гиббса (ΔG0) при нагревании 1 моля вещества (при постоянном давлении 1 атм), приведенного в табл. 14, от Т1 до Т2 К.
Таблица 14
| Вариант | Вещество | Т1, К | Т2 , К |
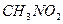 нитрометан нитрометан
| |||
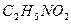 нитроэтан нитроэтан
| |||
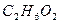 этиленгликоль этиленгликоль
| |||
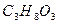 глицерин глицерин
| |||
 диметиламин диметиламин
| |||
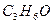 ацетон ацетон
| |||
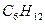 циклогексан циклогексан
| |||
 этилацетат этилацетат
| |||
 пропанол-1 пропанол-1
| |||
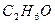 этанол этанол
| |||
 амиловый спирт амиловый спирт
| |||
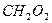 муравьиная кислота муравьиная кислота
| |||
 хлороформ хлороформ
| |||
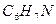 анилин анилин
| |||
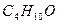 диэтиловый эфир диэтиловый эфир
|
Продолжение таблицы 14
| Вариант | Вещество | Т1, К | Т2 , К |
 пиридин пиридин
| |||
 валериановая кислота валериановая кислота
| |||
 толуол толуол
| |||
 октан октан
| |||
 муравьиная кислота муравьиная кислота
| |||
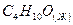 бутанол бутанол
| |||
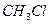 хлорметан хлорметан
| |||
 пентан пентан
| |||
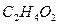 уксусная кислота уксусная кислота
| |||
 нитробензол нитробензол
| |||
 хлорбензол хлорбензол
| |||
 м-ксилол м-ксилол
| |||
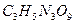 нитроглицерин нитроглицерин
| |||
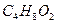 1,4-диоксан 1,4-диоксан
| |||
 бензол бензол
|
Решение:
Вычислим ΔG0 при нагревании 1 моля NH3 от T1 = 300 К до T2 = 400 К при постоянном давлении Р = 1 атм.
Вариант а) Изменение свободной энергии Гиббса в процессе нагревания вещества может быть определено из соотношения
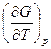 = —S. (49)
= —S. (49)
При p = const
dG = —SdT,
 . (50)
. (50)
Расчет можно вести с различной степенью точности.
Вариант а) Приближенный расчет, без учета зависимости энтропии от температуры проводится по уравнению
 , (51)
, (51)
которое получается после интегрирования уравнения (50) при условии S = const.
По справочным данным абсолютная энтропия аммиака при 298 К  = 192,66 Дж/моль·К.
= 192,66 Дж/моль·К.
 – 192,66·(400 – 300) = – 19266 Дж.
– 192,66·(400 – 300) = – 19266 Дж.
Вариант б) Более точный расчет можно провести, учитывая, что энтропия зависит от температуры. Для этого необходимо вывести уравнение зависимости S = f(T). Учтем, что
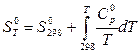 . (52)
. (52)
Если пренебречь зависимостью теплоемкости от температуры и проинтегрировать уравнение (52), считая  = const, тогда получим
= const, тогда получим
 .
.
Тогда из уравнения (50)
DG0 = – 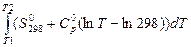 ,
,
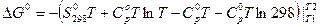 ,
,
DG0 = – (  (T2 – T1) +
(T2 – T1) + 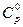 T2 lnT2 –
T2 lnT2 – 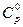 T1 lnT1 –
T1 lnT1 – 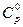 (T2 – T1) –
(T2 – T1) –
– 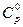 T2 ln298 +
T2 ln298 + 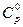 T1 ln298) = – ((
T1 ln298) = – ((  -
- 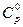 ) (T2 – T1) +
) (T2 – T1) +
+ 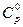 T2 (lnT2 – ln298)+
T2 (lnT2 – ln298)+ 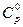 T1 (ln298 – lnT1),
T1 (ln298 – lnT1),
DG0 = ( 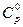 –
–  )(T2 – T1) –
)(T2 – T1) – 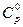 (T2 ln
(T2 ln 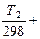 T1 ln
T1 ln  ). (53)
). (53)
Полученной формулой можно пользоваться для приближенного подсчета 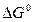 в небольшом интервале температур при условии
в небольшом интервале температур при условии 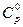 = const.
= const.
По справочным данным средняя теплоемкость аммиака в данном интервале температур 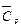 = 35,16 Дж/(моль·К), абсолютная энтропия аммиака при 298 К
= 35,16 Дж/(моль·К), абсолютная энтропия аммиака при 298 К  = 192,66 Дж/(моль·К).
= 192,66 Дж/(моль·К).
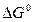 = (35,16 – 192,66)(400 – 300) – 35,16·400·ln
= (35,16 – 192,66)(400 – 300) – 35,16·400·ln  +
+
+ 35,16·300·ln 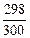 = – 19796 Дж.
= – 19796 Дж.
Вариант в) Точный расчет, с учетом того, что теплоемкость является функцией температуры.
По справочным данным зависимость теплоемкости аммиака от температуры выражается уравнением:
Ср NH3 = 29,80 + 25,48·10–3 T – 1,67·105/ T2.
Выведем зависимость энтропии от температуры с учетом зависимости теплоемкости от температуры:
 =
=  =
=
=  + a.lnT/298 + b(T – 298) – с//(2.Т2) + с//(2.2982).
+ a.lnT/298 + b(T – 298) – с//(2.Т2) + с//(2.2982).
Подставляя справочные данные, получим уравнение
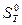 = 192,66 + 29,80 ln T – 29,80 ln298 + 25,48·10–3 T –
= 192,66 + 29,80 ln T – 29,80 ln298 + 25,48·10–3 T –
– 25,48·10–3·298 + 1,67·105/(2· Т 2) –1,67.105/(2.2982);
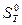 = 14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2.
= 14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2.
Подставим полученное уравнение в формулу для расчета функции энергии Гиббса (50):
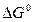 = –
= –  (14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2)dT,
(14,12 + 29,80 ln T + 25,48·10–3 T + 0,835·105/ Т 2)dT,
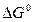 = – (14,12 T + 29,80· T ·ln T – 29,80 T + 25,48/2·10–3 T 2 –
= – (14,12 T + 29,80· T ·ln T – 29,80 T + 25,48/2·10–3 T 2 –
– 0,835·105/ Т) 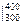 ,
,
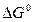 = – (14,12(400 – 300) + 29,80·400·ln400 – 29,80·300·ln 300 –
= – (14,12(400 – 300) + 29,80·400·ln400 – 29,80·300·ln 300 –
– 29,80(400 – 300) + 12,74·10–3 (4002 – 3002) – 0,835·105(1/400 –
– 1/300)) = – 19819 Дж.
Вариант г) Расчет с использованием приведенных функции энергии Гиббса
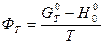 , (54)
, (54)
 , (55)
, (55)
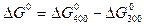 ,(56)
,(56)
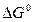 = 400 · DФ400 + DН00 – 300 · DФ300 – DН00 = 400 · DФ400 – 300 · DФ300.
= 400 · DФ400 + DН00 – 300 · DФ300 – DН00 = 400 · DФ400 – 300 · DФ300.
В справочнике отсутствует значение Ф400, найдем его путем интерполирования:
Ф298 = – 158,98 Дж/(моль·К), Ф500 = – 176,82 Дж/(моль·К)

Ф400 = –158,98 –8,92 = – 167,9 Дж/(моль∙К).
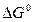 = 400·(–167,9) – 300·(–158,98) = – 19466 Дж.
= 400·(–167,9) – 300·(–158,98) = – 19466 Дж.
Дата публикования: 2014-11-18; Прочитано: 489 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
