 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лиофобные коллоидные системы. Строение коллоидных мицелл
|
|
Лиофобная коллоидная система состоит из частиц, составляющих дисперсную фазу – мицелл и дисперсионной среды – интермицеллярной жидкости. Для представления структур коллоидных мицелл применяют мицеллярные формулы.
Рассмотрим порядок написания таких формул на примере коллоидной частицы хлорида серебра, полученного реакцией обмена:
AgNO3 + KCl = AgCl↓ + KNO3.
Структура мицеллы AgCl будет определяться концентрацией компонентов AgNO3 и KCl, т.е. тем, какой компонент взят в избытке. При этом может быть в избытке AgNO3 (1 случай) или KCl (случай 2), или концентрации AgNO3 и KCl равны (случай 3).
Рассмотрим случай 1:
а) записывают формулу основного вещества – ультрамикрокристалла AgCl, состоящего из «m» молекул AgCl в квадратных скобках m[AgCl];
б) определяют, исходя из избытка компонента, потенциалопределяющие ионы, которые согласно правилу ионной адсорбции (правилу Пескова-Фаянса) должны быть родственными с твердой поверхностью, т.е. с ультрамикрокристаллом. В нашем случае это ионы «nAg+»;
в) ультрамикрокристалл вместе с потенциалопределяющими ионами образует ядро мицеллы m[AgCl]nAg+;
г) за ядром записывают противоионы адсорбционного слоя, т.е. ионы NO3ˉ, их число будет (n – x). Ядро и противоионы адсорбционного слоя образуют гранулу мицеллы, которая заключается в фигурные скобки и несет на себе заряд, отвечающий заряду потенциалопределяющих ионов; за гранулой записывают противоионы диффузного слоя. В целом эта структура носит название мицеллы.
 {m[AgCl]nAg+(n – x)NO3ˉ}х+ хNO3ˉ
{m[AgCl]nAg+(n – x)NO3ˉ}х+ хNO3ˉ
 ядро
ядро
 гранула
гранула
мицелла
Во 2 случае при избытке KCl формула мицеллы будет иметь вид:
{m[AgCl]nClˉ(n – x)K+}хˉ хK+.
В случае 3 система находится в изоэлектрическом состоянии и гранула не имеет заряда. Формула мицеллы имеет вид:
{m[AgCl]nAg+nNO3ˉ}0.
Типовые расчеты
Пример 1
Представить формулу мицеллы почвенного коллоида гидрозоля кремниевой кислоты, если гранула при электрофорезе перемещается к аноду.
Решение.
Основное вещество, образующее ультрамикрокристалл, это H2SiO3(SiO2·nH2O). Гранула перемещается к аноду, следовательно, она несет отрицательный заряд. Молекулы H2SiO3 частично диссоциируют на ионы: H2SiO3 ↔ 2Н+ + SiO32ˉ, из которых SiO32ˉ будут потенциалопределяющими, а противоионами будут Н+. Формула мицеллы будет иметь вид:
m[H2SiO3]nSiO32ˉ2(n – x)Н+}2х- 2хН+.
Пример 2
Составить формулу мицеллы и обозначить ее составные части, если она получена реакцией обмена между 20 мл раствора Ba(NO3)2, молярная концентрация эквивалента которого С(1/2 Ba(NO3)2) = 0,001 моль/л и 20 мл раствора Nа2SO4, С(1/2 Nа2SO4) = 0,02 моль/л.
Решение.
Рассчитаем число моль-эквивалентов компонентов Ba(NO3)2 и Nа2SO4 для того, чтобы определить, какой из них взят в избытке:
n Ba(NO3)2 = 20 · 0,001 = 0,02 ммоль;
n Nа2SO4 = 20 · 0,02 = 0,4 ммоль(избыток).
Уравнение реакции Ba(NO3)2 + Nа2SO4 = ВаSO4↓ + 2 NаNO3показывает, что труднорастворимое вещество и составляет основное вещество мицеллы, формула которой такова:
m[ВаSO4]n SO42ˉ2(n – x)Nа +}2х- 2хNа +.
Устойчивость коллоидных систем. Коагуляция и ее закономерности.
Агрегативная устойчивость – способность дисперсной системы сохранять неизменными размеры частиц дисперсной фазы. Однако большинство дисперсных систем обладают избытком поверхностной энергии, следовательно, в них могут самопроизвольно идти процессы укрупнения частиц. Такие системы называют агрегативно неустойчивыми.
Коагуляция – процесс потери агрегативной устойчивости коллоидных систем за счет слипания частиц и их укрупнения. Коагуляция зависит от изменения температуры, механических воздействий, концентрации системы, действия электролитов. Коагуляция вызывает увеличение мутности раствора, изменение окраски раствора, увеличение осмотического давления, возрастание вязкости.
Порог коагуляции (или критическая концентрация мицеллообразования) – наименьшая концентрация электролита γ, при которой начинается коагуляция:
γ =  ·1000, моль/л, (6.1)
·1000, моль/л, (6.1)
где Cэ, Vэ – концентрация и объем электролита соответственно;
Vз – объем золя.
Влияние электролитов на устойчивость дисперсных систем изучено Г. Шульце (Германия) и У. Гарди (Англия). Они установили, что:
1. Коагуляцию вызывает либо катион, либо анион электролита. Этот ион получил название иона-коагулянта.
2. Коагулирующее действие иона-коагулянта зависит от его заряда: чем больше заряд иона-коагулянта, тем его коагулирующее действие больше, а порог коагуляции меньше.
3. Знак заряда гранулы золя противоположен знаку заряда коагулирующего иона.
Типовые расчеты
Пример 3
Золь иодида серебра, получаемый по реакции:
KJ + AgNO3 = AgJ↓ + KNO3,
при некотором избытке KJ, коагулируют растворами нитрата калия и ацетата кальция. Коагулирующее действие какого электролита сильнее?
Решение.
Мицелла золя будет иметь следующее строение:
m[AgJ]nJˉ(n – x)К+}х- хК+.
По правилу Шульце-Гарди определяем ионы-коагуляторы. Исходя из знака заряда гранулы (он отрицательный), следует, что ионы-коагуляторы – катионы, т.е. Са2+ и К+. Для сравнения коагулирующего действия сравниваем заряды катионов. Коагулирующее действие ацетата кальция Са(СН3СОО)2 будет сильнее.
Пример 4
Почвенный коллоидный гидрозоль кремниевой кислоты объемом 100 мл подвергается коагуляции нитратом калия (V = 10 мл, С(КNO3) = 0,01 моль/л) и хлоридом железа (V = 10 мл, С(1/3 FeCl3) = 0,01 моль/л). Представить формулу мицеллы и определить направление движения гранулы при электрофорезе.
Решение.
Рассчитаем пороги коагуляции электролитов:
γ (КNO3) = 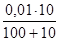 · 1000 = 9,09 ммоль/л,
· 1000 = 9,09 ммоль/л,
γ (FeCl3) = 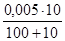 · 1000 = 0,05 ммоль/л.
· 1000 = 0,05 ммоль/л.
Из сравнения зарядов анионов NO3ˉ и Clˉ пороги коагуляции, если бы они вызывали коагуляцию, были бы равны. По расчету это не так, следовательно, коагуляцию вызывают катионы К+ и Fe3+. Значения порогов коагуляции подтверждают правило Шульце-Гарди (заряд Fe3+ > К+, а порог коагуляции 0,05 < 9,09). По правилу Шульце-Гарди знак заряда гранулы противоположен знаку заряда коагулирующего иона, т.е. гранула гидрозоля кремниевой кислоты отрицательна. Формула мицеллы имеет вид:
m[H2SiO3]nSiO32ˉ2(n – x)Н+}2х- 2хН+.
Растворы высокомолекулярных соединений (ВМС)
Основной признак ВМС – высокая молекулярная масса (не менее 10000). По ряду свойств растворы ВМС сходны с коллоидными, а именно:
- малая скорость диффузии;
- небольшое осмотическое давление;
- не проходят через полупроницаемые мембраны.
Однако растворы ВМС имеют молекулярную природу и являются не золями, а истинными, гомогенными системами. Отличия от коллоидных систем заключаются в следующем:
- растворы ВМС образуются самопроизвольно и в стабилизаторе не нуждаются;
- растворению ВМС предшествует процесс набухания. Степень набухания α может быть рассчитана по формуле:
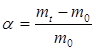 , (6.2)
, (6.2)
где m0 – навеска полимера до набухания, г;
mt – навеска полимера после набухания к данному моменту времени, г.
При ограниченном набухании рассчитывают скорость набухания:
 , (6.3)
, (6.3)
где 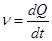 - скорость набухания;
- скорость набухания;
k – константа скорости набухания, зависящая от природы полимера, природы растворителя и температуры;
Qmax – предельное набухание;
Qt – набухание к данному моменту времени.
Расчет константы набухания проводят по уравнению:
 . (6.4)
. (6.4)
Дата публикования: 2014-11-18; Прочитано: 2860 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
