 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретические основы раздела. Известно, что любая поверхность обладает свободной поверхностной энергией G, величина которой определяется как произведение поверхностного натяжения σ на
|
|
Известно, что любая поверхность обладает свободной поверхностной энергией G, величина которой определяется как произведение поверхностного натяжения σ на величину площади поверхности S:
G = σ S. (5.1)
Самопроизвольное изменение концентрации вещества на поверхности раздела фаз по сравнению с его концентрацией внутри фазы называют адсорбцией.
Количественно процесс мономолекулярной адсорбции на поверхности раствора может быть выражен уравнением Гиббса:
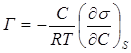 , (5.2)
, (5.2)
где Г – величина адсорбции, моль/м2;
с – концентрация вещества адсорбтива в растворе, моль/м3;
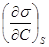 - поверхностная активность, характеризующая изменение σ в зависимости от концентрации при S = const;
- поверхностная активность, характеризующая изменение σ в зависимости от концентрации при S = const;
Т – температура системы, К;
R – универсальная газовая постоянная. Дж/моль К.
На границе фаз «жидкость – твердое тело» или «газ – твердое вещество» применяют уравнение Лэнгмюра:
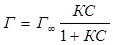 или
или  , (5.3)
, (5.3)
где Г – удельная адсорбция;
Г∞ - предельная максимальная адсорбция;
С – концентрация адсорбтива;
Р – давление адсорбтива;
К – постоянная величина.
Уравнение Лэнгмюра может быть представлено в виде:
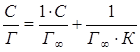 (5.4)
(5.4)
или
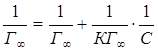 (5.5)
(5.5)
или
 , (5.6)
, (5.6)
где V – объем адсорбированного газа;
Vm – объем адсорбированного газа, полностью покрывающего поверхность 1 г адсорбента (объемы V и Vm приведены к нормальным условиям).
Графическое изображение уравнения приведено на рисунке:
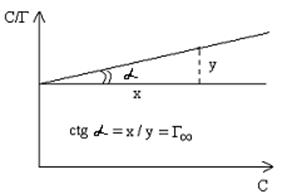
При известной величине Г∞ может быть вычислена площадь, занимаемая одной молекулой адсорбтива в состоянии насыщения:
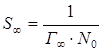 , м2/молекула (5.7)
, м2/молекула (5.7)
Толщина адсорбированного слоя δ вычисляется по уравнению:
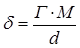 , (5.8)
, (5.8)
где М – молярная масса адсорбтива, г/моль;
d – плотность адсорбтива;
N0 – число Авогадро.
Площадь поверхности S 1 г адсорбтива равна:
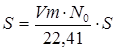 , (5.9)
, (5.9)
где S - площадь одной молекулы адсорбтива на поверхности адсорбента.
При адсорбции на поверхности многих адсорбентов образуется полимолекулярный адсорбционный слой. Полимолекулярная адсорбция описывается теорией БЭТ, которая устанавливает зависимость между адсорбционной емкостью насыщенного монослоя аm, удельной адсорбцией а, равновесным давлением газа Р и величиной k – константой, зависящей от энергии взаимодействия молекул в адсорбционном слое.
Уравнение БЭТ в виде уравнения прямой линии имеет вид:
 , (5.10)
, (5.10)
где PS – давление насыщенного пара.
Для определения удельной поверхности адсорбента S строят график зависимости: 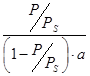 от
от 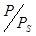 .
.
По угловому коэффициенту прямой, равному (k – 1)(kam)-1, и величине отрезка, отсекаемого на оси ординат при 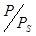 = 0, равного (kam)-1 рассчитывается am. Удельная поверхность S вычисляется по формуле:
= 0, равного (kam)-1 рассчитывается am. Удельная поверхность S вычисляется по формуле:
S = S0 ∙ am ∙ N0, (5.11)
где S0 – площадь, занимаемая одной молекулой газа в адсорбционном слое;
N0 – постоянная Авогадро.
На практике для вычисления величины адсорбции получило распространение также эмпирическое уравнение Фрейндлиха:
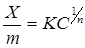 , (5.12)
, (5.12)
где Х – количество адсорбированного вещества, моль;
m – масса адсорбента, г;
С – равновесная концентрация;
К и n – эмпирические константы.
В логарифмическом виде уравнение Фрейндлиха представляет уравнение прямой:

При графическом построении в осях координат «lg X/m – lg C» отрезок, отсекаемый прямой на оси ординат, дает значение lg K, а тангенс угла дает значение 1 / n, т.к. последний составляет угловой коэффициент в уравнении 5.13:
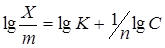 . (5.13)
. (5.13)
Дата публикования: 2014-11-18; Прочитано: 657 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
