 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Программы для самостоятельной работы. 1. Найти разность между Qp и Qv при 250С для следующих реакций:
|
|
Программа № 1
1. Найти разность между Qp и Qv при 250С для следующих реакций:
СО2 (г) + 3Н2 (г) = СН4 (г) + Н2О (ж),
С2Н5ОН (ж) = С2Н2 (г) + Н2О (ж),
4NO2 (г) + 6H2O (ж) = 4NH3 (г) + 5O2 (г).
2. Рассчитать ∆Н0298 реакции спиртового брожения глюкозы:
С6Н12О6 (кр) = 2С2Н2ОН (ж) + 2СО2 (г).
3. Используя данные по стандартным энтальпиям сгорания, рассчитать стандартную энтальпию образования С6Н6 (ж).
4. Рассчитать изменение энтропии для реакции гидролиза АТФ:
АТФ + Н2О = АДФ + НРО42- + Н+.
5. Используя стандартные значения ∆G0298, рассчитать константу равновесия Кр для реакции образования β-аланина из аспарагиновой кислоты.

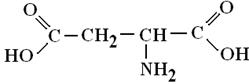
→
Программа № 2
1. Определить изменение энтальпии образования сероуглерода СS2 (ж) в стандартных условиях, используя следующие термохимические уравнения:
S (кр) + O2 (г) = SO2 (г) – 297,2 кДж/моль,
CS2 (ж) + 3O2 (г) = CO2 (г) + 2SO2 (г) – 1105 кДж/моль,
С (гр) + О2 (г) = СО2 (г) – 393,4 кДж/моль.
2. Вычислить ∆Н0298 для реакции гидролиза мочевины:
СО(NH2)2 (г) + Н2О (ж) = СО2 (г) + 2NН3 (г).
3. Определить, какое количество энергии в форме теплоты выделяется при взаимодействии 40 г оксида фосфора (V) с водой:
Р2О5 (тв) + Н2О (ж) = 2НРО3 (тв).
4. ∆G0298 реакции окисления глюкозы до углекислого газа и воды равна -2880 кДж/моль. Часть этой энергии в количестве 1140 кДж/моль запасается клетками для выполнения работы. Какое количество энергии запасается в клетках при поступлении в нее 0,5 г глюкозы.
5. В растениях происходят гидролитическое расщепление мочевины до углекислого газа и воды. Оценить константу равновесия Кр в стандартных условиях и направление процесса гидролиза:
СО(NH2)2 (тв) = 2NH3 (г) + СО2 (г).
Программа № 3
1. Вычислить ∆Н0298 реакции образования СН3СООН (ж) из простых веществ, используя данные по стандартным энтальпиям сгорания.
2. Используя справочные данные, определить, какая из реакций превращения глюкозы в организме поставляет больше энергии:
С6Н12О6 (кр) = 2С2Н5ОН (ж) + 2СО2 (г),
С6Н12О6 (кр) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
3. Найти разность между Qp и Qv для реакции окисления метана в стандартных условиях:
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (ж).
4. При смешивании уксусной кислоты и этилового спирта при стандартных условиях происходит реакция:
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж).
Оценить направление процесса и рассчитать константу равновесия Кс.
5. ∆Н0298 обр. L-аланина равна -563,5 кДж/моль, а ∆S0298 – 645,5 Дж/моль К. Рассчитать свободную энергию Гиббса.
Программа № 4
1. Рассчитать изменение энтальпии образования ацетона С3Н6О (ж) из простых веществ в стандартных условиях, используя справочные данные о стандартных энтальпиях сгорания.
2. Используя справочные данные, вычислить ∆Н0298 обр. глутамина в реакции:
глутамин (тв) + Н2О (ж) =
= глутаминовая кислота (тв) + NH3 (г) – 136,0 кДж/моль.
3. Определить ∆Н0298 и ∆U0298 для реакции окисления аммиака:
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6Н2О (ж).
4. Предсказать направления процесса реакции горения метана СН4 (г) в стандартных условиях:
СН4 (г) + 2О2 (г) = 2СО2 (г) + 2Н2О (ж).
5. В отсутствии денатурирующих агентов константа равновесия Кр реакции образования беспорядочного клубка лизина при 298 К и рН = 7 равна 7,8. Рассчитать ∆G0298 и оценить биологический аспект полученной величины.
Программа № 5
1. Рассчитать стандартную энтальпию образования глюкозы С6Н12О6 (кр) из простых веществ, используя данные о стандартных энтальпиях сгорания.
2. Рассчитать изменение энтальпии для реакции:
Н2 (г) + ½ О2 (г) = Н2О (ж),
при 423 К, если ∆Н0298 = -285,9 кДж/моль, теплоемкость в стандартных условиях С0р 298 (О2, г) = 29,36 Дж/моль К, С0р 298 (Н2, г) = 28,84 Дж/моль К, С0р 298 (Н2О, ж) = 75,3 Дж/моль К.
3. Используя справочные данные для реакции:
С12Н22О11 (кр) + 12О2 (г) = 12СО2 (г) + 11Н2О (ж) – 5694 кДж/моль,
вычислить стандартную энтальпию образования сахарозы из простых веществ.
4. Предсказать направление реакции в стандартных условиях:
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г).
5. Рассчитать энергию Гиббса процесса растворения аденина в воде и метаноле при 310 К, если ∆Н растворения в воде и метаноле соответственно равны 29580 Дж/моль и 16569 Дж/моль, а ∆S - 25,5 и 39,3 Дж/моль К. Где растворимость аденина выше?
Программа № 6
1. В результате реакции, протекающей в стандартных условиях, образовалось 10 л угарного газа:
2С (гр) + О2 (г) = 2СО (г).
Определить количество энергии в форме теплоты, выделившейся в результате реакции.
2. ∆Н0298 реакции денатурации лизоцина в соляной кислоте равна -93,6 кДж/моль. Рассчитать изменение энтальпии при 363 К, если ∆Ср = 1,375 Дж/моль К.
3. При растворении 16 г карбида кальция в воде в стандартных условиях выделилось 31,3 кДж энергии в форме теплоты. Определить стандартную энтальпию образования Са(ОН)2 (кр).
4. Для реакции гидролиза АТФ в организме:
АТФ + Н2О = АДФ + НРО42- + Н+,
при 310 К ∆G и ∆Н соответственно равны -30,96 и -20,08 кДж/моль. Рассчитать изменение энтропии в этом процессе и сделайте вывод о направлении процесса.
5. Оценить возможность реакции растворения АТФ при 298 К и рН = 7, если энтальпия растворения 21,3 кДж/моль, а энтропия = -54,4 Дж/моль К.
Программа № 7
1. Оксид ртути (II) и хлороводород взаимодействуют по уравнению:
HgO (тв) + 2HCl (г) = H2O (ж) + HgCl2 (тв).
Определить, какое количество энергии в форме теплоты выделится в стандартных условиях, если в реакцию вступит 433,2 г HgO.
2. Используя справочные данные по энтальпиям сгорания, рассчитать стандартную энтальпию образования метанола СН3ОН (ж) из простых веществ.
3. Рассчитать ∆S0298 процесса обмена на поверхности карбоксиметилцеллюлозы иона К+ на ион Na+, если ∆Н0298 = -23,0 кДж/моль, ∆G0298 = 0,66 кДж/моль.
4. Найти разность между ∆Н0298 и ∆U0298 для реакций:
FeO (кр) + CO (г) = Fe (кр) + CO2 (г),
CaCO3 (кр) = CaO (кр) + CO2 (г).
5. Оценить влияние гидрофобного эффекта при переносе аденина из уксусной кислоты в воду, если ∆Н = 10920 Дж/моль, ∆S = 35,1 Дж/моль К.
Программа № 8
1. Стандартная энтальпия реакции окисления глюкозы равна -2801,7 кДж/моль. Используя справочные данные, рассчитать стандартную энтальпию образования глюкозы:
С6Н12О6 (кр) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж) – 2801,7 кДж/моль.
2. Определить энтальпию денатурации транспортной РНК дрожжей при 800С, если ∆Н при 570С = 515 кДж/моль, а ∆Ср = 5,021 Дж/моль К.
3. По энтальпиям сгорания водорода, углерода и глицина, рассчитать энтальпию образования глицина из простых веществ при стандартных условиях.
4. ∆G0298 реакции составляет 47,2 кДж/моль. Рассчитать константу равновесия Кр для данных условий:
глюкоза (кр) + АТФ (кр) = глюкозо-6-фосфат (кр) + АДФ (кр).
5. Определить ∆Н0298 и ∆U0298 для реакции горения метанола:
СН3ОН (ж) + 2О2 (г) = СО2 (г) + 2Н2О (г).
Программа № 9
1. Рассчитать изменение внутренней энергии для стандартных условий спиртового брожения глюкозы:
С6Н12О6 (тв) = 2С2Н5ОН (ж) + 2СО2 (г).
2. Рассчитать ∆Н некоторой реакции при 323 К, если ∆Ср = 1,375 Дж/моль К и ∆Н0298 = -93,62 кДж/моль.
3. Определить, какое количество энергии в форме теплоты выделяется при взаимодействии 30 г оксида фосфора (V) с водой:
Р2О5 (тв) + Н2О (ж) = 2НРО3 (тв).
4. Реакция образования дипептида аланилглицин имеет константу равновесия Кр = 1∙10-3. Может ли процесс протекать самопроизвольно в стандартных условиях?
5. Определить ∆G0298 процесса сорбции паров воды крахмалом, если энтальпия процесса равна -71 кДж/моль, а энтропия 188 Дж/моль К.
Программа № 10
1. При сгорании 1 г бензойной кислоты в калориметре при стандартных условиях выделилось 28434,5 Дж энергии в форме теплоты. Определить стандартную энтальпию образования бензойной кислоты.
2. Определить разность Qp и Qv для реакции:
Н2 (г) + ½ О2 (г) = Н2О (ж).
3. Вычислить стандартную энтальпию образования сахарозы С12Н22О11 (кр) из простых веществ, если стандартная энтальпия сгорания ∆Н0298 сгорания = -569 кДж/моль.
4. Изменение свободной энергии Гиббса ∆G0298 для реакции:
глюкоза + АТФ = глюкоза-6-фосфат + АДФ
составляет -47,2 кДж/моль. Рассчитать константу равновесия Кр для этих условий.
5. Рассчитать ∆G0298 для перехода твердой кислоты в жидкость при 363 К, если ∆Н = -4,1 кДж/моль, а ∆S = 11 Дж/моль К.
Программа № 11
1. Используя справочные данные, рассчитать для стандартных условий энтальпию реакции молочнокислого брожения глюкозы:
С6Н12О6 (тв) = 2С3Н6О3 (ж).
2. В стандартных условиях восстановление оксида свинца (IV) описывается термохимическим уравнением:
PbO2 (тв) + H2 (г) = PbO (тв) + H2O (ж) – 182,8 кДж/моль.
Рассчитать стандартную энтальпию образования PbO2.
3. Найти разность между Qp и Qv для реакции горения сероуглерода в стандартных условиях: CS2 (ж) + 3O2 (г) = CO2 (г) + 2SO2 (г).
4. Используя справочные данные, найти ∆G0298 гликогена для следующего процесса: 6О2 (г) + гликоген (тв) = 6СО2 (г) + 6Н2О (ж).
∆G0298 для данной реакции равна -9092,8 кДж/моль.
5. Рассчитать изменение энтропии при образовании из простых веществ в стандартных условиях D-глюкозы С6Н12О6 (тв).
Программа № 12
1. Вычислить ∆Н0298 для реакции горения метана:
СН4 (г) + 2О2 (г) = СО2 (г) + 2 Н2О (ж).
2. При растворении 16 г карбида кальция в воде выделилось 31,3 кДж энергии в форме теплоты. Определить ∆Н0298 обр. Са(ОН)2 (тв).
3. Используя справочные материалы по энтальпиям сгорания в стандартных условиях, определить стандартную энтальпию образования мочевины СО(NН2)2 (тв) из простых веществ.
4. Даны два пути метаболического превращения глюкозы в животных организмах: С6Н12О6 (тв) = 2С2Н5ОН (ж) + 2СО2 (г),
С6Н12О6 (тв) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
Какой из них предоставляет наибольшее количество свободной энергии для совершения полезной работы?
5. Используя справочные данные по энтальпиям сгорания рассчитать изменение энтальпии образования из простых веществ в стандартных условиях метанола СН3ОН (ж).
Программа № 13
1. Используя справочные данные, рассчитать для стандартных условий энтальпию образования из простых веществ пальмитиновой кислоты С15Н31СООН (тв), если стандартная энтальпия ее сгорания ∆Н0298 = -9796 кДж/моль.
2. Рассчитать ∆Н0298 для реакции гидратации этилена:
С2Н4 (г) + Н2О (ж) = С2Н5ОН (ж).
3. Найти разность между Qp и Qv для реакции окисления глюкозы:
С6Н12О6 (тв) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж).
4. ∆G0298 и ∆Н0298 для гидролиза АТФ составляют 20,16 кДж/моль и -29,4 кДж/моль. Рассчитать изменение энтропии для этих условий.
5. Рассчитать константу равновесия Кр реакции дегидратации этанола для стандартных условий, используя справочные данные о свободной энергии Гиббса: С2Н5ОН (ж) = С2Н4 (г) + Н2О (ж).
Программа № 14
1. Вычислить ∆Н0298 обр. глутамина, исходя из реакции:
глутамин (тв) + Н2О (ж) =
= глутаминовая кислота (тв) + NH3 (г) – 136,0 кДж/моль.
2. Вычислить стандартную энтальпию образования D-рибозы С5Н10О5 (тв) из простых веществ, если стандартная энтальпия ее сгорания равна 2218,5 кДж/моль.
3. Этилен в стандартных условиях взаимодействует с водой по уравнению:
С2Н4 (г) + Н2О (ж) = С2Н5ОН (ж).
Вычислить, какое количество энергии в форме теплоты выделится, если в реакцию вступит 700 л этилена.
4. Используя справочные данные, определить, возможен ли в стандартных условиях гидролиз мочевины в почве:
СО(NH2)2 (тв) = 2NH3 (г) + СО2 (г).
5. Синтез АТФ из АДФ и Н3РО4 требует в стандартных условиях затраты энергии ∆G0298 = 31,4 кДж/моль. Рассчитать константу равновесия Кр для этих условий.
Программа № 15
1. Рассчитать изменение энтальпии при 423 К для реакции:
Н2 (г) + ½ О2 (г) = Н2О (ж),
если ∆Н0298 = -285,9 кДж/моль. Для расчета ∆Ср использовать справочные данные.
2. При растворении 32 г карбида кальция СаС2 в воде выделилось 62,6 кДж энергии в форме теплоты. Рассчитать стандартную энтальпию образования гидроксида кальция.
3. Рассчитать изменение энтальпии образования ацетона из простых веществ в стандартных условиях, используя справочные данные о стандартных энтальпиях сгорания.
4. Определить, может ли самопроизвольно протекать реакция гидролиза глюкозо-6-фосфата, если константа равновесия Кр при 250С равна 19.
5. Используя справочные данные, предсказать направление процесса горения метана в стандартных условиях:
СН4 (г) + 2О2 (г) = СО2 (г) + 2 Н2О (ж).
Дата публикования: 2014-11-18; Прочитано: 2114 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
