 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Первый закон (начало) термодинамики
|
|
Первый закон термодинамики является выражением закона сохранения энергии, который утверждает, что в любой изолированной системе общий запас энергии сохраняется постоянным. Применение этого закона для выяснения связи между внутренней энергией, работой и теплотой составляет суть первого начала термодинамики.
В любом процессе изменение внутренней энергии ΔU системы равно разности количества теплоты Q, сообщенной системе, и работы W, совершаемой системой:
ΔU = Q – W; Q = ΔU + W. (1.1)
Термохимия – раздел химической термодинамики, изучающий тепловые эффекты химических реакций и базирующийся на первом начале термодинамики. Тепловым эффектом реакции называется теплота химического процесса при постоянном объеме или давлении, постоянной температуре и отсутствии всех видов работ, кроме работы расширения.
Теплота изохорно-изотермического процесса равна изменению внутренней энергии, т.к. работа расширения отсутствует:
Qv = ΔU.
Теплота изобарно-изотермического процесса равна изменению энтальпии:
Qp = ΔU + pΔv = U2 – U1 + pv2 – pv1 = (U2 + pv2) – (U1 + pv1) = H2 – H1 = ΔH.
Энтальпия Н – энергия расширенной системы, отличается от внутренней энергии на величину работы расширения: Н = U + pv.
В реакции с участием только твердых или жидких веществ объемы исходных веществ и продуктов приблизительно одинаковы, поэтому ΔН ≈ ΔU. В реакциях с участием газов объем может заметно изменяться, тогда:
ΔU = ΔН – ΔnRT, (1.2)
где Δn – изменение числа молей газообразных веществ;
R – универсальная газовая постоянная, равная 8,314 Дж/Кмоль;
Е – абсолютная температура.
Основным законом термохимии является закон Гесса. Используя закон Гесса, можно рассчитать тепловые эффекты одних реакций, зная тепловые эффекты других.
Тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется только химическим составом и агрегатным состоянием участников реакции.
Для практических расчетов часто пользуются величинами энтальпий образования и энтальпий сгорания веществ.
Энтальпия любой химической реакции ΔН0298 х.р. может быть рассчитана по стандартным энтальпиям образования ее участников (исходных веществ и продуктов реакции) по следующему уравнению:
ΔН0298 х.р. = ΣΔН0298 обр. прод. – ΣΔН0298 обр. исх. в-в. (1.3)
Энтальпия любой химической реакции ΔН0298 х.р. может быть вычислена также и по стандартным энтальпиям сгорания ее участников по уравнению:
ΔН0298 х.р. = ΣΔН0298 сгор. исх. в-в – ΣΔН0298 сгор. прод. (1.4)
Стандартные энтальпии сгорания веществ приведены в приложении.
Типовые расчеты
Пример 1
При сгорании 1 л водорода, измеренного при н.у., выделяется 12,75 кДж тепла. Определить энтальпию образования Н2О (ж).
Решение.
Образование 1 моля воды происходит при сгорании 22,4 л водорода. Составляем пропорцию: 1 л – 12,75 кДж,
22,4 л – Х кДж.
Х = ΔН0298 обр. воды = -285,6 кДж/моль.
Пример 2
Определить измерение внутренней энергии реакции ΔН0298 х.р. сгорания графита: 2С (гр.) + О2 (г) = 2СО (г).
Решение.
Известно, что ΔU = ΔН – ΔnRT.
ΔН0298 х.р. = 2ΔН0298 (СО, г) – ΔН0298 (С, гр.) – ΔН0298 (О2, г) = 2ΔН0298 (СО, г).
ΔН0298 обр. простых веществ равна нулю.
ΔН0298 х.р. = 2 ∙ (-110,35) = -220,7 кДж.
Изменение числа молей реакции Δn = 2 – 1 = 1.
Следовательно, ΔU0298 х.р. = -220,7 – 1 ∙ 8,31 ∙ 10-3 ∙ 298 = -223,8 кДж/моль.
Пример 3
Рассчитать энтальпию реакции гидролиза мочевины, если даны стандартные энтальпии образования компонентов:
ΔН0298 обр. (СО2, г) = -393,52 кДж/моль,
ΔН0298 обр. (СО(NН2)2, тв.) = -332,85 кДж/моль,
ΔН0298 обр. (Н2О, ж) = -285,57 кДж/моль,
ΔН0298 обр. (NН3, г) = -48,19 кДж/моль.
Решение.
Гидролиз мочевины описывается уравнением:
СО(NH2)2 (тв.) + Н2О (ж) = СО2 (г) + 2NH3 (г).
ΔН0298 х.р. = ΔН0298 обр. (СО2, г) + 2 ΔН0298 обр. (NH3, г) –
– ΔН0298 обр. (Н2О, ж) – 2 ΔН0298 обр. (СО(NH2)2, тв.),
ΔН0298 х.р. = -393,52 + 2 ∙ (-48,19) – (-285,57) – (-332,85) = 119,52 кДж.
Пример 4
Рассчитать энтальпию образования бензола, если известны энтальпии сгорания бензола, углеводорода и водорода.
ΔН0298 сг. (С, гр.) = ΔН0298 обр. (СО2, г) = -393,52 кДж/моль,
ΔН0298 сг. (Н2, г) = ΔН0298 обр. (Н2О, ж) = -285,57 кДж/моль,
ΔН0298 сг. (С6Н6) = -3564,6 кДж/моль.
Решение.
Уравнение реакции образования бензола из простых веществ имеет следующий вид: 6С (гр.) + 3Н2 (г) = С6Н6 (ж).
ΔН0298 х.р. = 6 ∙ (-393,52) + 3 ∙ (-285,57) – (-3264,6) = 50,55 кдж/моль.
Величина теплового эффекта реакции зависит от температуры, так как при изменении температуры меняется теплоемкость химических соединений.
Зависимость теплового эффекта от температуры описывается уравнением Кирхгоффа:
ΔНт2 = ΔНт1 + 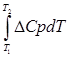 , (1.5)
, (1.5)
где ΔНт2 – тепловой эффект реакции при температуре Т2;
ΔНт1 – тепловой эффект реакции при температуре Т1;
ΔСр – изменение теплоемкости веществ, участвующих в реакции.
При использовании стандартных величин уравнение Кирхгоффа имеет вид:
ΔНт2 = ΔН0298 х.р. + ΔСр (Т2 – 298). (1.6)
ΔСр = ∑n Ср прод. – ∑n Ср исх. в-в. (1.7)
Пример 5
Рассчитать тепловой эффект реакции:
2СН4 (г) = С2Н2 (г) + 3Н2 (г),
при 725 оС, если ΔН0298 обр. (СН4) = -74,85 кДж/моль, ΔН0298 обр. (С2Н2) = 226,75 кДж/моль, Ср (Н2) = 2957 Дж/моль К, Ср (СН4) = 54,52 Дж/моль К, Ср (С2Н2) = 57,46 Дж/моль К.
Решение.
Рассчитаем стандартную энтальпию реакции:
ΔН0298 х.р. = 226,75 – 2 ∙ (-74,85) = 376,45 кДж/моль.
Рассчитаем изменение теплоемкости веществ:
ΔСр = (57,46 + 3 ∙ 29,57) – 2 ∙ 54,52 = 37,13 Дж/моль К.
Находим тепловой эффект реакции при температуре 725 оС:
ΔН0298 х.р. = 376,45 + 37,13 ∙ 10-3 ∙ (988 – 298) = 402,44 кДж/моль.
Дата публикования: 2014-11-18; Прочитано: 1710 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
