 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Реакция второго порядка
|
|
Для реакции А + В → Р, где [А] = [В], имеем:
 . (2.5)
. (2.5)
Решение этого уравнения приводит к зависимости:
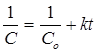 , (2.6)
, (2.6)
где С – текущая концентрация вещества А;
Со – исходная концентрация вещества А;
t – время реакции.
Решая уравнение относительно константы скорости, получаем:
 . (2.8)
. (2.8)
Графически данное уравнение решается в координатах «1/С – время».

Если отнести уравнение (2.8) к моменту τ1/2, когда израсходована половина взятого количества одного из исходных веществ, то получим:
 или
или 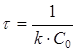 , (2.9)
, (2.9)
т.е. в реакциях второго порядка период полупревращения зависит от начальной концентрации реагирующих веществ.
Типовые расчеты
Пример 2
Реакция второго порядка за 500 секунд проходит на 20%. За какое время она пройдет на 60%?
Решение.
Так как константа скорости реакции второго порядка подчиняется уравнению (2.8), то для различных значений начальной и конечной концентраций имеем:
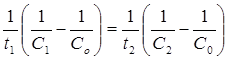 .
.
Принимая С0 за 100%, С1 – за 80%, С2 – за 40%, имеем:
 , отсюда х = t2 = 3000 секунд.
, отсюда х = t2 = 3000 секунд.
Дата публикования: 2014-11-18; Прочитано: 1549 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
