 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимости скорости реакции от температуры
|
|
Общий характер зависимости скорости от температуры установил С. Аррениус в 1889 году:

 , (2.10)
, (2.10)
где А – постоянная, характеризующая каждую реакцию;
Е – энергия активации;
R – универсальная газовая постоянная;
Т – абсолютная температура.
Если учесть взаимосвязь констант скорости при температурах Т1 и Т2, можно получить следующее уравнение:
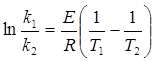 , (2.11)
, (2.11)
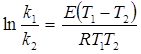 . (2.12)
. (2.12)
Типовые расчеты
Пример 3
Константы скорости реакции первого порядка при температурах 300 и 310 К равны соответственно 3,4 и 8,5 минут. Рассчитать энергию активации для данной реакции.
Решение.
Используя предыдущие соотношения, получаем:
 . Подставляя данные примера, получаем:
. Подставляя данные примера, получаем:
 = 2,3 ∙ 0,4 ∙ 8,31 ∙ 300 ∙ 31 = 71,1 кДж/моль.
= 2,3 ∙ 0,4 ∙ 8,31 ∙ 300 ∙ 31 = 71,1 кДж/моль.
Дата публикования: 2014-11-18; Прочитано: 468 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
