 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Определение константы равновесия реакции йода с йодидом калия
|
|
Реактивы и оборудование: делительные воронки, установка для титрования, конические колбы на 250 мл, растворы КJ с молярной концентрацией эквивалента 0,1 и 0,05 моль/л.
В водном растворе между йодом и йодистым калием имеет место взаимодействие, которое можно представить уравнением:
Jˉ + J2 = Jˉ3 .
Константу равновесия можно представить выражением:
К равн. = [Jˉ3] / [J2] ∙ [Jˉ],
где [Jˉ3], [J2], [Jˉ ] - равновесные молярные концентрации.
Методика эксперимента
Работа состоит из двух опытов, включающих в себя определение коэффициента распределения йода между водой и ССl4 и определения константы равновесия реакции: Jˉ + J2 = Jˉ3.
Опыт 1
Цель опыта – определить коэффициенты распределения йода между водой и четыреххлористым углеродом.
Коэффициент распределения йода γ представляет собой отношение равновесных концентраций йода в воде и ССl4:
γ = 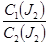 ,
,
где С1(J2) – концентрация йода в водном слое;
С2(J2) – концентрация йода в ССl4.
Для экспериментального определения γ поместить в одну делительную воронку 150 мл Н2О, насыщенную йодом и 10 мл четыреххлористого углерода. В другую делительную воронку поместить 150 мл воды и 10 мл четыреххлористого углерода, насыщенного йодом. Делительные воронки плотно закрыть пробками и встряхивать в течение 15 – 20 минут. Затем воронки закрепить в штативе и оставить до полного разделения слоев.
Затем провести разделение слоев и определить концентрацию J2 в обоих слоях. Для этого взять 5 мл органического слоя ССl4 и 100 мл водного раствора и титровать по отдельности раствором тиосульфата натрия Na2S2O3 концентрацией 0,5 моль/л в присутствии крахмала. По полученным данным найти коэффициент распределения.
Опыт 2
В трех делительных воронках приготовить следующие смеси:
первая воронка: 50 мл раствора KJ (С = 0,1 моль/л), 10 мл ССl4, насыщенного J2; вторая воронка: 50 мл раствора KJ (С = 0,05 моль/л), 10 мл ССl4, насыщенного J2; третья воронка: 50 мл раствора KJ (С = 0,1 моль/л), 5 мл ССl4, насыщенного J2, 5 мл чистого ССl4.
Смеси встряхивать в течение 20 минут и после расслаивания разделить слои. На титрование взять 5 мл органического слоя и 20 мл водного слоя из каждой воронки. Титровать раствором тиосульфата натрия и по результатам титрования определить С1(J2) и С2(J2).
Расчеты вести следующим образом.
1. Определить равновесную концентрацию [J2], используя выражение:
[J2] = γ ∙ С2(J2).
2. Учитывая, что аналитическая концентрация J2 в водном слое С1(J2) включает сумму [J2] и [Jˉ3], найти [Jˉ3]: С1(J2) = [J2] + [Jˉ3], а [Jˉ3] = С1(J2) - [J2].
3. Иодид калия нерастворим в ССl4, поэтому сумма равновесных концентраций ионов [Jˉ] и [Jˉ3] соответствует концентрации KJ в воде. Из уравнения можно рассчитать [Jˉ]: С (KJ) = [Jˉ] + [Jˉ3].
4. Рассчитав концентрации [Jˉ], [J2] и [Jˉ3], определить Кс и свободную энергию Гельмгольца по уравнению: ∆А0298 = - 2,3 R T lgKc.
Дата публикования: 2014-11-18; Прочитано: 1772 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
