 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Согласно второму началу термодинамики, всякая термодинамическая система стремится к такому состоянию
|
|
Согласно второму началу термодинамики, всякая термодинамическая система стремится к такому состоянию, которое является наиболее вероятным в данных условиях по сравнению с любым другим, т.е. к равновесному состоянию.
Равновесие системы не означает прекращения процесса, а наступает тогда, когда скорость прямой реакции становится равной скорости обратной реакции: Vпр. = V обр.
Согласно закону действующих масс для реакции mА + bВ = cС + qG:
К равн. =  , (1.15)
, (1.15)
где К равн. – константа химического равновесия;
[A], [B], [C], [G] – равновесные концентрации реагирующих веществ;
c, b, q, m – стехиометрические коэффициент.
Если концентрация реагирующих веществ выражена в моль/л, то константу равновесия обозначают Кс. Если концентрация реагирующих газообразных реагентов выразить через парциальные давления, то константу равновесия обозначают Кр.
Между Кр и Кс существует взаимосвязь, выражаемая следующим отношением:
Кс = Кр  , (1.16)
, (1.16)
где ∆n – изменение числа молей газообразных реагентов в процессе реакции.
Если реакция протекает без изменения числа молей, то Кр = Кс. Константа химического равновесия позволяет прогнозировать направление процесса. Если Кравн. >> 1, то рассматриваемый процесс протекает со значительным выходом конечных продуктов, т. е. равновесие смещено вправо. Если Кравн. << 1, то выход продуктов реакции мал и равновесие процесса смещено влево.
Известно, что направление процесса определяет свободная энергия Гиббса ∆G и энергия Гельмгольца ∆А. Существует взаимосвязь между величинами ∆G, ∆А и Кравн.:
∆А0298 = - R T ln Kc (V = const, T = const). (1.17)
∆G0298 = - R T ln Kp (p = const, T = const). (1.18)
Заменяя натуральный логарифм ln на десятичный lg, получим:
∆А0298 = - 2,3 R T lg Kc. (1.19)
∆G0298 = - 2,3 R T lg Kp. (1.20)
Соотношения 1.17 – 1.20 позволяют рассчитать свободные энергии Гиббса или Гельмгольца, если даны константы равновесия и наоборот.
Типовые расчеты
Пример 10
Рассчитать константы равновесия реакции Кр и Кс для реакции:
N2O2 (г) = 2NO2 (г) при 250С, если ∆G0298 х. р. = 4852,98 кДж/моль.
Решение.
Исходя из уравнения ∆G0298 х. р. = - 2,3 R T lgKp, рассчитаем Кр.
lgKр = 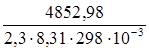 = -0,85, Kр = 0,141.
= -0,85, Kр = 0,141.
Тогда Кс = Кр  = 0,141 ∙
= 0,141 ∙ 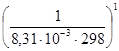 = 6∙10-3.
= 6∙10-3.
Пример 11
Определить изменение энергии Гиббса ∆G0298 для реакции:
Н2 (г) + J2 (г) = 2НJ (г), если Кс = 1,84∙10-2.
Решение.
Так как реакция протекает без изменения числа молей, то Кр = Кс. По уравнению изобары:
∆G0298 = -2,3 R T lgKp = -2,3 ∙ 8,31 ∙ 10-3 ∙ 298 ∙ lg1,84 ∙ 10-2 = 9,91 кДж/моль.
После изучения темы «Химическая термодинамика» необходимо
знать:
■ формулировку и физический смысл первого начала термодинамики;
■ термодинамические функции (внутренняя энергия, энтальпия системы, энтропия системы, свободная энергия системы), их физический смысл;
■ понятие о тепловом эффекте, закон Гесса, формулы расчета теплового эффекта реакции по энтальпиям образования и сгорания веществ;
■ зависимость теплового эффекта от температуры (уравнение Кирхгоффа);
■ формулировки и физический смысл второго закона термодинамики;
■ критерии направления самопроизвольных процессов;
■ связь константы равновесия с изменением свободной энергии системы;
уметь:
■ рассчитывать энтальпию реакции по энтальпиям образования и сгорания веществ, участвующих в реакции;
■ рассчитывать изменение энтропии и свободной энергии реакции;
■ оценивать направление самопроизвольного процесса.
Дата публикования: 2014-11-18; Прочитано: 732 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
