 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Глава 3. Химическая кинетика и катализ. Равновесие
|
|
3.1. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: под скоростью химической реакции понимают изменение концентрации одного из участников реакции в единицу времени при неизменном объёме системы. При этом не важно о каком из участвующих в реакции веществ идет речь, так как все они связаны между собой уравнением реакции, а потому по изменению концентрации одного из веществ можно судить о соответствующих изменениях концентрации всех остальных. Концентрацию (С) выражают в моль/л, а время (t) в секундах или минутах.
Средняя скорость реакции равна 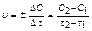 .
.
Знак минус ставится потому, что, несмотря на убывание концентрации одного из реагирующих веществ А или В и, следовательно, на отрицательное значение разности С2 - С1, С2 < С1, DС < О, скорость реакции может быть только положи-тельной величиной. Если же следить за изменением концентрации одного из про-дуктов реакции С или D, то она в ходе реакции будет возрастать С2 > С1, DС > О, и поэтому в правой части приведенного уравнения надо ставить знак плюс.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ (закон действующих масс): u = k  C(A)
C(A)  C(B), где
C(B), где
С(А) и С(В) - молярные концентрации А и В, k - константа скорости реакции зависит от природы веществ и от температуры.
Для гомогенной реакции общего вида: а А + в В = с С + d D
u = k  Ca(A)
Ca(A)  Cb(B)
Cb(B)
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называют кинетическим уравнением реакции.
Для гетерогенной реакции вида: 1) А(г) + 2В(тв) = АВ2 (ж) u = k . С(А)
2) А(г)+ 2В(ж) = АВ2 (ж) u = k . С(А)
3) А(ж) + 2В(тв) = АВ2 (ж) u = k . С (А)
Таким образом, в кинетическое уравнение не входит концентрация твёрдого вещества (всегда), а жидкого - в реакции с газом.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, которое математически выражается соотношением: 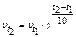 , где
, где
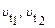 - скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
- скорость реакции соответственно при начальной и конечной темпе-ратурах; g - температурный коэффициент, который показывает во сколько раз увеличилась константа скорости реакции при увеличении температуры на 100.
Правило Вант-Гоффа является приближенным, более точно зависимость скорости от температуры выражается уравнением Аррениуса:
 , где
, где
A - постоянная, независящая от температуры; e = 2,17828 (основание натураль-ного логарифма); Eакт - энергия активации; R = 8,314 Дж/моль . K (газовая постоянная); T - абсолютная температура (Т = t + 273).
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 527 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
