 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. При состоянии равновесия в системе N2(г) + 3H2(г) ↔2NH3(г); DН = -92,4кДж концентрации веществ равны: [N2] = 3моль/л; [H2] = 9моль/л; [NH3] =
|
|
Пример 1. При состоянии равновесия в системе N2(г) + 3H2(г) ↔2NH3(г); DН = -92,4кДж концентрации веществ равны: [N2] = 3моль/л; [H2] = 9моль/л; [NH3] = 4моль/л. Определите: а) константу равновесия реакции; б) исходные концентрации N2 и H2; в) в каком направлении сместится равновесие с ростом температуры; с уменьшением объёма реакционного сосуда?
Решение: а) в соответствии с уравнением реакции константа равновесия определяется соотношением: Kс = 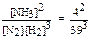 = 0,0073.
= 0,0073.
Kс << 1, т.е. равновесие смещено влево, преобладает обратная реакция.
б) исходная концентрация вещества складывается из прореагировавшей и равновесной: C(N2) = C ¢ (N2) + [N2]; C(H2) = C ¢ (H2) + [H2].
Из уравнения реакции видно, что для образования 2 моль NH3 расходуется 1 моль N2 и 3 моль Н2. Т.к. в момент равновесия [NH3] = 4 моль/л, то С ¢ (N2) = 2 моль/л; C ¢ (H2) = 6 моль/л: C(N2) = 3 + 2 = 5 (моль/л), C(H2) = 9 + 6 = 15 (моль/л).
в) при увеличении температуры равновесие сместится влево, в сторону эндотермической реакции; при уменьшении объёма реакционного сосуда увеличивается давление и равновесие смещается вправо, в сторону уменьшения числа молей газовой смеси.
Ответ: Kс = 0,0073; 5 моль/л N2, 15 моль/л Н2.
Пример 2. Константа равновесия реакции FeO(K) + CO(г)  Fe(K) + CO2(г) при некоторой температуре равна 0,5. Вычислите равновесные концентрации CO и CO2, если начальные концентрации составляли: C(CO2) = 0,05 моль/л; C(CO2) = 0,01 моль/л.
Fe(K) + CO2(г) при некоторой температуре равна 0,5. Вычислите равновесные концентрации CO и CO2, если начальные концентрации составляли: C(CO2) = 0,05 моль/л; C(CO2) = 0,01 моль/л.
Решение: запишем выражение константы равновесия: Kс =  = 0,5.
= 0,5.
Пусть прореагировало х моль СО, тогда по уравнению реакции из х моль СО получилось х моль СО2. Тогда:
[CO] = C(CO) - C'(CO) = (0,05 - х) моль/л
[CO2] = C(CO2) - C'(CO) = (0,01 + х) моль/л
Kс =  = 0,5. Отсюда х = 0,01 моль.
= 0,5. Отсюда х = 0,01 моль.
Тогда равновесные концентрации будут равны:
[CO] = 0,05 - 0,01 = 0,04 (моль/л)
[CO2] = 0,01 + 0,01 = 0,02 (моль/л)
Ответ: [CO] = 0,04 M, [CO2] = 0,02 M.
Пример 3. При отравлениях арсенатами в крови обнаруживают 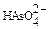 ионы, способные замещать
ионы, способные замещать 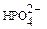 ионы в процессе метаболизма. Рассчитайте равновесную концентрацию
ионы в процессе метаболизма. Рассчитайте равновесную концентрацию  ионов в водном растворе, если [
ионов в водном растворе, если [ 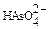 ] =
] =
10-4 моль/л, а константа равновесия для реакции 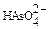 ↔ H++
↔ H++ 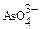 при 250 равна 10-12.
при 250 равна 10-12.
Решение: 1) По закону действующих масс: Kс =  = 10-12.
= 10-12.
2) По уравнению реакции [ 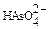 ] = [H+] и пусть равно х моль/л, тогда Kс =
] = [H+] и пусть равно х моль/л, тогда Kс = 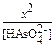 = 10-12. Отсюда x =
= 10-12. Отсюда x =  = 10-8 моль/л.
= 10-8 моль/л.
Ответ: 10-8 моль/л.
Пример 4. Чему равна массовая доля водорода и йода, превращающихся в йодоводород, если они взяты в реакцию по 1 моль каждый, а константа равновесия при температуре опыта равна 4?
Решение: составим таблицу:
H2 + I2 ↔ 2HI
Взято, моль/л 1 1
К моменту равновесия прореагировало х х
Осталось 1- х 1- х
Образовалось 2 х
Если равновесные концентрации водорода и йода составляют 1 - х, а йодоводорода 2 х моль/л, то
Kр =  = 4, отсюда х = 0,5 (моль/л).
= 4, отсюда х = 0,5 (моль/л).
Таким образом, массовые доли Н2 и I2, превратившихся в HI, равны и составляют 50%.
Ответ: 50%.
Пример 5. Для реакции 2CO2 ↔ 2CO + O2 при 20000С состав равновесной смеси выражается объёмными долями: 85,2% CO2, 9,9%CO и 4,9%O2, а общее давление в системе составляет 101,3 кПа. Чему равна константа равновесия этой реакции при данной температуре, выраженная через:
а) парциальные давления реагирующих веществ (Kp),
б) их молярные концентрации (Kс)?
Решение: парциальное давление газа равно общему давлению, умноженному на объёмную долю газа в смеси, поэтому:
а) р(CO2) = 101,3 . 0,852 = 86,3 (кПа)
б) p(CO) = 101,3 . 0,099 = 10,0 (кПа)
в) p(O2) = 101,3 . 0,049 = 4,9 (кПа)
Kp =  = 0,067.
= 0,067.
Для данной реакции Dn = 3-2= 1. Тогда Kр = 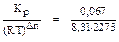 = 3,6.
= 3,6.
Ответ: Kp = 0,067; Kc = 3,6.
Пример 6. Какими способами в системе: 2SO2 + O2 ↔ 2SO3 - DH можно смещать равновесие в сторону большего выхода SO3 при заданной концентрации SO2?
Решение: по принципу Ле Шателье это достигается:
а) повышением концентрации О2;
б) уменьшением концентрации SO3 (удаления из сферы реакции);
в) повышением давления;
г) понижением температуры до такого ее значения, при котором скорость реакции еще достаточна для относительно быстрого достижения равновесия.
Вопросы и задачи для самоподготовки
1. Какие реакции называют: а) необратимыми; б) обратимыми; в) прямыми; г) обратными? Приведите соответствующие примеры.
2. Одинаковы или различны значения констант скоростей для прямой и обратной реакции? Объясните.
3. Как изменяются скорости прямой и обратной реакции? Чем обусловлено и в какое состояние приводит данную систему?
4. Что называют химическим равновесием? Почему оно является динами-ческим? Что понимают под равновесной концентрацией?
5. Что называют константой химического равновесия? Зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления?
6. Объясните, почему числовое значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции.
7. Почему в выражение для константы равновесия не входят концентрации веществ, находящихся в твердой фазе?
8. Какими параметрами характеризуется химическое равновесие? Перечислите.
9. Какой процесс называют смещением (сдвигом) химического равновесия.
10.На конкретных примерах покажите, как смещается равновесие системы под влиянием изменения: а) концентрации одного из реагирующих веществ; б) температуры; в) давления.
11.Скорость какой химической реакции (экзо- или эндотермической) больше увеличивается при нагревании равновесной системы?
12. Влияет ли катализатор на положение равновесия и почему? Зависит ли константа равновесия от катализатора?
13. Для какой реакции - прямой или обратной - энергия активации больше, если прямая реакция идет с выделением теплоты?
14. Если при данной температуре константа скорости прямой реакции имеет большее значение, чем константа скорости обратной, то какая из них будет экзотермической?
15. Напишите выражение Kр для следующих реакций:
а) 2NО(г) + О2(г) ↔2 NО2(г) б) СH3СООН(р) ↔ СН3СОО- (р) + Н+(р)
в) МgСО3(к) ↔ МgО(к) + СО2(г) г) [НgJ4]2- (р) ↔ Нg2+(р) + 4I- (р)
д) Н2О(ж) ↔ Н+(р) + ОН- (р) е) 3Fe(к) + 4Н2О(ж) ↔ Fe3О4(к) + 4Н2(г)
16. При 4500С константа равновесия реакции Н2 + I2↔ 2НI равна 50. Чему равна константа равновесия реакции диссоциации НI при той же температуре? Ответ: 0,02.
17. Вычислите константу равновесия для гомогенной реакции А + В ↔ С + D, если исходные концентрации веществ А и В были равны по 0,8 моль/л, а равновесная концентрация вещества С равна 0,6моль/л. Ответ: 9.
18. Какое значение имеет константа равновесия Kр реакции: 2НI(г) ↔ Н2(г) + I2(г) при 4480С, если парциальные равновесные давления газов при этой температуре составляют: p (HI) = 40,5 кПа, р (H2) = 75,2кПа, р (I2) = 0,436 кПа? Ответ: 0,02.
19. В системе РСI5(г) ↔ РСI3(г) + СI2(г) равновесиe при 500 K установилось, когда исходная концентрация РСI5, равная I моль /л, уменьшилась до 0,46 моль/л. Вычислите Kр этой реакции при указанной температуре. Ответ: 0,634.
20. Рассчитайте константу равновесия реакции: 4НСI (г)+ О2 (г) ↔ 2СI2(г) + 2Н2О(г), если начальные количества веществ были 2,4 моль НСI и 1,2 моль О2, а к моменту наступления равновесия осталось непрореагировавшим 0,8 моль хлороводорода. Объём реакционного сосуда равен 4 л. Ответ: 0,625.
21.Определите константу равновесия реакции: N2(г)+ 3Н2(г) ↔ 2NH3(г), если при некоторой температуре в реакционный сосуд, объёмом 10 л введено 0,05 моль N2 и 0,52 моль Н2, а к моменту установления равновесия образовалось 0,04 моль аммиака. Ответ: 54,8.
22. При 6500С константа равновесия системы СО2(г)+Н2(г) ↔ СО(г)+Н2О(г) равна единице. В начальный момент концентрации СО2 и Н2 были соответственно
равны 0,2 и 0,8 моль/л. Вычислите равновесные концентрации всех реагирующих веществ. Ответ: 0,04; 0,64; 0,16; 0,16 моль/л.
23. Для реакции FeO(к) + CO(г) ↔ Fe(к) + CO2(г) константа равновесия при 10000С равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль /л. Определите их равновесные концентрации.
Ответ: 0,04 и 0,02 моль/л.
24. Рассчитайте константу равновесия реакции N2O4  2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4. Ответ: 0,16.
2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% N2O4. Ответ: 0,16.
25. Какие условия будут способствовать большему выходу SO3 по реакции 2SO2 + О2 ↔ 2SO3; DН0298 = -98,9 кДж/моль? Какая масса SО2 израсходуется при образовании SO3 массой 10 г? Ответ: 8 г.
26. В какую сторону сместится равновесие реакции:
а) 2Н2S(г) ↔2H2(г) + S2(к) ; DН = 40,13 кДж
б) N2O4(ж) ↔2NO2(г); DН = 66,55 кДж
в) СО(г) + Н2О(г) ↔СО2(г) + Н2(г); DН = -40,96кДж
1) при повышении температуры;
2) при повышении давления?
27. В какую сторону будет смещаться равновесие при повышении температуры в системе:
а) N2 (г) + 3H2 (г) ↔ 2NH3 (г), DH0298 = -92,4 кДж
б) 2CO2 (г) ↔ 2CO(г) + O2 (г), DH0298 = 566 кДж
в) 4HCl(г) + O2(г) ↔ 2Cl2(г) + 2H2O(ж), DH0298 = -202,4 кДж
28. Укажите, какими изменениями концентрации реагирующих веществ можно сместить вправо равновесие реакции: CO2(г)+ C(графит) ↔ 2CO(г).
Глава 4. ОСНОВЫ ЭЛЕКТРОХИМИИ
4.1. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ. КОНДУКТОМЕТРИЯ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: электрическая проводимость раствора – это свойство, характеризующее способность проводить электрический ток. Она зависит от количества и природы ионов, природы растворителя и температуры раствора.
Так, сопротивление проводника прямо пропорционально его длине и обратно пропорционально поперечному сечению:  , Ом.
, Ом.
Где r – удельное сопротивление, т.е. сопротивление столба жидкости при l = 1 cм и S = 1см2.
Удельная электропроводность раствора – величина, обратная удельному сопротивлению ϰ = 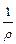 . Удельная электропроводность раствора – это электро-проводность раствора объемом 1 см3, помещенного между электродами пло-
. Удельная электропроводность раствора – это электро-проводность раствора объемом 1 см3, помещенного между электродами пло-
щадью 1 см2, находящимися на расстоянии 1 см. Она выражается в Ом–1.см–1 (в системе СИ измеряется в Ом–1.м–1 или в См/м; 1 Сименс = 1Ом−1). Удельная электропроводность электролитов зависит от природы растворителя и раство-ренного вещества, его степени диссоциации, от концентрации ионов, от их движения в электрическом поле, температуры и напряженности поля.
Электропроводность столба жидкости (раствора), содержащего 1 грамм-эквивалент электролита, помещенного между электродами, находящимися на расстоянии 1 см называется э квивалентной электропроводностью. Ее обозна-чают буквой l («лямда»). Она равна произведению удельной электропровод-ности и разбавления: lv = ϰ. V или 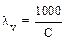 ϰ, см2/ом.моль (в системе СИ измеряется в м2/ом.моль). Разбавлением (разведением) называется объем раствора, в котором растворен 1 грамм-эквивалента и V = 1/C(1/zX).
ϰ, см2/ом.моль (в системе СИ измеряется в м2/ом.моль). Разбавлением (разведением) называется объем раствора, в котором растворен 1 грамм-эквивалента и V = 1/C(1/zX).
Эквивалентная электропроводность зависит от тех же факторов, что и удельная. С разбавлением эквивалентная электропроводность возрастает до определенного (предельного) значения и после чего не изменяется, что объясняется уменьшением межионного взаимодействия и в конечном итоге его исчезновением. Предельное значение, к которому стремится величина эквивалентной электропроводности при концентрации, стремящейся к нулю, называют эквивалентной электропроводностью при бесконечном разведении. Ее обозначают l¥. При таком разведении эквивалентная электропроводность зависит только от скорости движения ионов.
При бесконечном разведении раствора электролита катионы и анионы пере-носят электрический ток независимо друг от друга и эквивалентная электропро-водность электролита определяется суммой эквивалентных электропроводностей (электроподвижностей) ионов (закон Кольрауша или закон независимого движе-ния ионов): l¥ = lк + lа.
Произведение числа Фарадея на абсолютную скорость иона называется подвижностю иона: l = F . u, см2/ом . моль.
По эквивалентной электропроводности можно рассчитать степень диссоциа-ции слабых электролитов. При разбавлении слабых электролитов степень их дис-социации возрастает, число ионов увеличивается. Поэтому по мере разбавления раствора увеличивается эквивалентная электропроводность, достигая макси-мального значения при бесконечном разведении. Таким образом, эквивалентная электропроводность пропорциональна степени диссоциации электролита: lv = Ka. Учитывая, что при бесконечном разведении a = 1, lv = l¥, тогда K = l¥. Подставляя это значение в предыдущее уравнение получаем, что lv= l¥a.
Откуда степень диссоциации электролита при данном разведении будет равна: 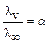 . Это соотношение называется соотношением Аррениуса.
. Это соотношение называется соотношением Аррениуса.
Заменив степень диссоциации на отношение эквивалентных электропровод-ностей в уравнении закона разведения Оствальда, можно вычислить константу диссоциации слабых электролитов:  .
.
Для сильных электролитов соотношение электропроводностей при данном и бесконечном разведениях показывает во сколько раз действительное значение электропроводности меньше теоретически рассчитанного и обозначается коэффициентом электропроводности: 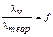 . Он, как и коэффициент активности, зависит от межионного взаимодействия в растворах.
. Он, как и коэффициент активности, зависит от межионного взаимодействия в растворах.
Исследования электрической проводимости подразделяют на прямую кондуктометрию и кондуктометрическое титрование.
В прямой кондуктометрии по электрической проводимости находят степень и константу диссоциации электролитов, константу устойчивости комплексных соединений, произведение растворимости солей, концентрацию растворенного электролита, примеси сильных электролитов и др.
Электрическую проводимость определяют по сопротивлению, которого изме-ряют с помощью кондуктометра и кондуктометрической ячейки. Для измерения
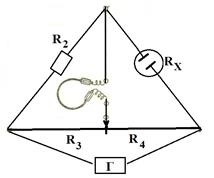 Рис.1. Мост Кольрауша:
Г− генератор, Rx – сопротивление ячейки;
R2 – магазин сопротивлений, R3 и R4 – сопротивления, определяемые по реохорду.
Рис.1. Мост Кольрауша:
Г− генератор, Rx – сопротивление ячейки;
R2 – магазин сопротивлений, R3 и R4 – сопротивления, определяемые по реохорду.
| сопротивления раствор помещают в кондуктометрическую ячейку, которая представляет собой сосуд, в который опущены электроды. Форма сосудов для измерения электропроводности разнообразна. Если сопротивление раствора измеряется в одном и том же сосуде, причем объем раствора, площадь электродов и расположение их остаются постоянными, а уровень раствора в сосуде на несколько миллиметров выше электродных пластин, то R = Kr, откуда K = ϰR (измеряется в 1/см). Коэффициент пропорциональ ности Kназывается |
константой сосуда или емкостью сопротивления сосуда. Для определения константы сосуда, в нем измеряют сопротивление стандартного раствора с известной удельной электропроводностью, чаще раствора KCl. Далее измеряют сопротивление сосуда с исследуемым раствором и вычисляют удельную электропроводность исследуемого раствора по формуле: ϰ = 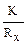 .
.
Для измерения сопротивления электролита пользуются мостовой схемой (мостиком Кольрауша, рис.1). В качестве нулевого прибора в этой схеме
применяют телефон или индикатор нуля осциллографического типа, а электри-ческие колебания звуковой частоты получают при помощи звукогенератора, которого подсоединяют реохорду, замыкая первую цепь. Вторая цепь состоит из сопротивления Rх исследуемого раствора в сосуде и известного сопротивления R, набранного в магазине сопротивлений. Передвигая подвижный контакт по проволоке реохорда, находят такое положение контакта, когда нулевой прибор покажет отсутствие тока в мостике, перекинутом между первой и второй цепью. Сопротивление Rх при этом можно вычислить по формуле:

При кондуктометрическом титровании по изменению электропроводности контролируют взаимодействие реагирующих веществ. Изменение электропро-водности при этом связано с изменением концентрации ионов или заменой одного вида ионов другим, отличным по своей подвижности. Обычно это изме-нение представляют в виде графика (кондуктограммы) и по точке резкого излома или изгиба кривой определяют эквивалентную точку. Концентрацию растворен-ного вещества определяют по закону эквивалентов. Кондуктометрическое тит-рованиеприменяется в случае анализа окрашенных и мутных растворов, для определения содержания нескольких веществ.

Рис.2. Кривые кондуктометрического титрования сильного (а), слабого электролита (б), смеси слабой и сильных электролитов (в).
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 11491 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
