 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Гомогенная реакция между веществами А и В протекает по урав-нению 2А + В = С, концентрация вещества А равна 6 моль/л
|
|
Пример 1. Гомогенная реакция между веществами А и В протекает по урав-нению 2А + В = С, концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2  моль-2
моль-2  с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Решение:
Согласно закону действующих масс: u = k  C2(A)
C2(A)  C(B). Скорость химической реакции в начальный момент равна u0 = 0,5
C(B). Скорость химической реакции в начальный момент равна u0 = 0,5  62
62  5 = 90,0 (моль
5 = 90,0 (моль  л-1
л-1  с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45
с-1). По истечении некоторого времени в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет равной С1(В) = 0,45  5 = 2,25 (моль/л).
5 = 2,25 (моль/л).
Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 (моль/л).
Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75  2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
2) и стала равной 6,0 - 5,5 = 0,5 (моль/л).
Скорость химической реакции в тот момент, когда в реакционной смеси останется 45% вещества В, станет u1 = 0,5  (0,5)2
(0,5)2  2,25 = 0,28 (моль
2,25 = 0,28 (моль  л-1
л-1  с-1).
с-1).
Ответ: u0 = 90,0 моль/(л . с), u1 = 0,28 моль/(л . с).
Пример 2. Окисление глюкозы в организме протекает через несколько проме-жуточных стадий по суммарному уравнению: С6Н12О6 (т) + 6О2 (г) = 6СО2 (г) + Н2О(ж). Запишите кинетическое уравнение этой реакции и определите, как изменится скорость реакции: а) в условиях высокогорья, где концентрация кислорода вдвое меньше; б) в барокамере, где давление воздуха вдвое больше атмосферного.
Решение: запишем кинетическое уравнение реакции окисления глюкозы:
u = k  C6(O2)
C6(O2)
Обозначим начальную концентрацию О2 через а моль/л, тогда u0 = k  а 6
а 6
а) В условиях высокогорья С1(О2) = а /2 моль/л. u1 = k  (а /2)6 =
(а /2)6 = 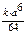 . Определим как изменяется скорость:
. Определим как изменяется скорость: 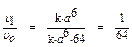 .
.
Следовательно, скорость реакции уменьшается в 64 раза.
б) В барокамере С(О2) = 2 а моль/л. u2 = k  (2 а)6 = 64.k
(2 а)6 = 64.k  а 6. Определим, как изменится скорость:
а 6. Определим, как изменится скорость:  .
.
Следовательно, скорость реакции увеличивается в 64 раза.
Пример 3. Во сколько раз уменьшится скорость окисления глюкозы в организме, если уменьшить температуру тела с 37° до 30° при температурном коэффициенте g = 1,7?
Решение: по правилу Вант-Гоффа: 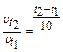 ,
,  .
.
Следовательно, скорость реакции уменьшилась в 1,5 раза.
Пример 4. При увеличении температуры от 10° до 50°С скорость реакции увеличилась в 16 раз. Определите её температурный коэффициент.
Решение: по правилу Вант-Гоффа: 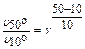 , g 4 = 16; g =
, g 4 = 16; g = 
Ответ: температурный коэффициент реакции равен 2.
Пример 5. Раствор лекарственного вещества содержит 500 активных единиц в 1мл. Через 40 дней в нём осталось 20 единиц в мл. Реакция протекает по первому порядку. Рассчитайте константу скорости и период полупревращения реакции.
Решение: для реакции 1-го порядка  ,
,
где С0 и Сt - начальная и текущая концентрации, а t - время.
t = 24 . 40 (дней) = 960 (часов).
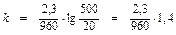 = 0,0034 (час-1)
= 0,0034 (час-1)
 = 203,5 (час) = 8,5 (дней).
= 203,5 (час) = 8,5 (дней).
Пример 6. В ферментативной реакции через час после её начала осталось 48 г субстрата, а через 3 часа - 27 г. Определите начальную концентрацию субстрата, считая, что реакция имеет первый порядок.
Решение: для реакции 1-го порядка: 
 ;
; 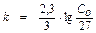 ;
; 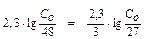
 ; С0 = 63,97 г субстрата.
; С0 = 63,97 г субстрата.
Пример 7. Как изменится скорость реакции: 4HCl + O2 ® 2Cl2 + 2H2O, протекающей в газовой фазе, если увеличить в три раза:
1) концентрацию кислорода;
2) концентрацию хлороводорода;
3) давление в системе?
Решение: если обозначить концентрации HCl и O2 соответственно через x и y, то выражение для скорости реакции примет вид: u = k . C4(HCl) . C(O2) = k  x 4
x 4  y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3 y для O2, поэтому:
y. После увеличения концентрации в 3 раза они будут равны 3 x для HCl и 3 y для O2, поэтому:
1) u = k  x 4
x 4  3 y = 3k
3 y = 3k  x 4
x 4  y. Увеличение скорости реакции по отношению к первоначальной составляет:
y. Увеличение скорости реакции по отношению к первоначальной составляет: 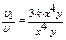 = 3.
= 3.
2) u = k  (3 x)4
(3 x)4  y = 81
y = 81  k
k  x 4
x 4  y, u2/u = 81.
y, u2/u = 81.
3) Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому: u3 = k  (3 x)4
(3 x)4  3
3  y = 243k
y = 243k  x 4
x 4  y, u3/u = 243.
y, u3/u = 243.
Вопросы и задачи для самоподготовки.
1.Что изучает химическая кинетика? Какова ее практическая цель?
2. Что называется скоростью химической реакции, какова её размерность?
3. Дайте определения и приведите примеры гомогенных и гетерогенных реакций. Как находятся их скорости?
4. От каких факторов зависит скорость химических реакций? Сформулируйте закон действующих масс.
5. Что называют константой скорости? Каков физический смысл этой величины? Зависит ли константа скорости от температуры, природы реагирующих веществ и их концентрации?
6. Изменится ли значение константы скорости реакции: а) при замене одного катализатора другим; б) при изменении концентрации реагирующих веществ?
7. Что такое молекулярность реакции; порядок реакции? Приведите примеры моно-, ди- и тримолекулярных реакций; реакций нулевого, первого, второго, третьего порядков.
8. Напишите кинетические уравнения следующих химических реакций:
а) H2 (г) + Cl2 (г) ® 2 HCl (г)
б) 2 NO (г) + O2 (г) ® 2 NO2(г)
в) CaO(т) + CO2(г)® CaCO3(г)
г) 4NH3(г) + 3 О2(г) ® 2 N2(г) + 6H2O(г)
д) FeO(т) + H2(г) ® Fe(т) + H2O(ж)
9. Какими формулами выражаются правило Вант-Гоффа, уравнение Аррениуса, определяющие зависимость скорости реакции от температуры?
10. Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения?
11. Почему повышение температуры увеличивает скорость реакции? Какие молекулы называют активными?
12. Скорость каких реакций в большей степени зависит от температуры - тех, у которых энергия активации небольшая или наоборот?
13.Что такое активированный комплекс, энергия активации? Изобразите энергетическую диаграмму реакции, идущей с образованием активированного комплекса.
14.Сущность катализа. Механизм гомогенного и гетерогенного катализа. Понятие о ферментативном катализе.
15.Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от её структуры?
16. При взаимодействии SO2 и O2 концентрация последнего уменьшилась за 1 час на 0,25 моль/л. Как изменится при этом концентрация SO2 и чему равна средняя скорость реакции?
Ответ: уменьшится на 0,5 моль/л; 8,33 . 10−3 моль/л  с.
с.
17. При синтезе аммиака к данному моменту времени прореагировало 0,9 моль/л водорода, а его начальная концентрация равна 1,4 моль/л. Определите концентрацию оставшегося водорода и прореагировавшего азота.
Ответ: 0,5 и 0,3 моль/л.
18. Найдите константу скорости гомогенной реакции 2А + В ® С, зная, что при концен-трациях А и В, соответственно равных 0,5 и 0,6 моль/л, её скорость составляет 0,018 моль/(л  мин). Ответ: 0,12 л2/моль2
мин). Ответ: 0,12 л2/моль2  мин.
мин.
19. Гомогенная реакция идет по уравнению А + 2В ® С; константа её скорости при данной температуре равна 0,4 л2/моль2  с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л
с, а начальные концентрации составляют: 0,3 моль/л вещества А и 0,5 моль/л вещества В. Вычислите скорость этой реакции при той же температуре в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03 и 0,0072 моль/л  с.
с.
20. Для того, чтобы увеличить в 216 и 256 раз скорость реакции синтеза NH3, во сколько раз надо повысить в первом случае концентрацию H2, а во втором - давление? Ответ: увеличить в 6 и 4 раза.
21. Температурный коэффициент реакции равен 2,5. Как изменится её скорость: а) при повышении температуры от 800 до 1400С; б) при охлаждении реакционной смеси от 500 до 300С.
Ответ: а) увеличится в 244; б) уменьшится в 6,25 раза.
22. При 1500С некоторая реакция заканчивается за 16 мин. Принимая темпера-турный коэффициент скорости реакции равным 2,5, рассчитайте, через какое время закончится эта реакция, если проводить её: а) при 2000С; б) при 800С? Ответ: а) 9,8 с; б) 162,77 час.
23. Во сколько раз увеличится скорость реакции, протекающей при 298 K, если энергию активации её уменьшить на 4 кДж/моль? Ответ: в 5 раз.
3.2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: химическое равновесие устанавливается в системах, в которых протекают обратимые химические реакции. Количественно оно характеризуется константой равновесия (K). Для гомогенной реакции общего вида аА + вВ ↔ сС + dD:
Kр =  , где
, где
[A], [B], [C], [D] - равновесные молярные концентрации веществ A, B, C и D.
Для гетерогенной реакции вида:
1) A(г) + 2B(ТВ) ↔ AB2(ж) Kс = 
2) А(г) + 2В(ж) ↔ АВ2(ж) Kс = 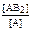
3) А(ж) + 2В(тв) ↔ АВ2(ж) Kс = 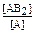
Таким образом, концентрация твёрдого вещества (всегда), жидкого (в реакциях с газами) не входит в выражение константы равновесия, как и в кинетическое уравнение химической реакции.
Константа равновесия, равная отношению констант скоростей прямой (k1) и обратной (k2) реакции зависит от температуры и от природы реагирующих веществ, но не зависит от их концентрации: Kр = 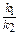 .
.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газов - и давление. При изменении одного из этих параметров равновесие нарушается и концентрации всех реагирующих веществ изменяются до тех пор, пока не установится новое равновесие, но уже при других значениях равновесных концентраций. Такой переход называется сдвигом или смещением химического равновесия.
О направлении сдвига равновесия судят по принципу Ле Шателье, в соот-ветствии с которым увеличивается скорость той реакции (прямой или обрат-ной), которая ослабляет внешнее воздействие. Действительно, если увеличить, например, концентрацию [С], то должна уменьшиться концентрация [D], и
увеличиться концентрация [А] и [В], т.е. это приведёт к смещению равновесия в сторону исходных веществ.
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 4223 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
