 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. В 1 л воды растворяется 2,88.10-6 г AgI
|
|
Пример 1. В 1 л воды растворяется 2,88 . 10-6 г AgI. Вычислите ПР(AgI).
| Дано: V(H2O) = 1 л m(AgI) = 2,88.10-6г. ПР(AgI) =? | Решение:
AgI (тв) 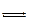 Ag+(р-р) + I-(р-р)
ПР(AgI) = [Ag+].[I-]
[Ag+] = [I-] = C(AgI) = Ag+(р-р) + I-(р-р)
ПР(AgI) = [Ag+].[I-]
[Ag+] = [I-] = C(AgI) = 
|
1) V(p-pa)» V(H2O) = 1 л, M(AgI) = 235 г/моль
2) C(AgI) = = 1,225 . 10-8 (моль/л)
3) ПР(AgI) = (1,225 . 10-8)2 = 1,5 . 10-16.
Ответ: 1,5 . 10-16
Пример 2. Образуется ли осадок Fe(OH)3 в растворе, содержащем 1,5 . 10-3 моль/л FeCl3 и 5 . 10-5 моль/л NaOH? ПР(Fe(OH)3) = 3,8 . 10-38.
Дано:
C(FeCl3)= 1,5.10-3моль/л
C(NaOH) = 5.10-5 моль/л
ПP(Fe(OH)3) = 3,8.10 -38
ИП   ПР -? ПР -?
| Решение: Fe(OH)3(тв) «Fe3+(р-р) + 3 OH-(р-р) ПP(Fe(OH)3) = [Fe3+].[OH-]3 1) [Fe3+] = C(FeCl3) = 1,5.10-3 моль/л 2) [OH-] = C(NaOH) = 5.10-5 моль/л 3) ИП(Fe(OH)3) = [Fe3+].[OH-]3 = 1,5.10-3.(5.10-5)3 = 1,9.10-6 |
4) ИП >> ПР, следовательно, осадок образуется.
Ответ: осадок образуется.
Пример 3. При какой концентрации ионов Al3+ будет образовываться осадок
Al(OH)3 из раствора с рН = 6? ПР(Al(OH)3) = 5,1 . 10-33.
| Дано: pH = 6 ПР(Al(OH)3) = 5,1 . 10-33 [Al3+] =? | Решение:
Al(OH)3(тв) «Al3+(р-р) + 3 OH-(р-р)
[OH-] = 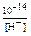 ; ; 
|
1) [H+] = 10-pH = 10-6 (моль/л);
2) [OH-] = 10-14/10-6 = 10-8 (моль/л);
3) [Al3+] =  = 5,1 . 10-9 (моль/л).
= 5,1 . 10-9 (моль/л).
Ответ: 5,1 . 10-9 моль/л.
Пример 4. В растворе содержатся ионы кальция, свинца и стронция с концентрацией 1.10−3 моль/л. В этот раствор по каплям внесли раствор сульфата натрия до концентрации этой соли до 1.10−3 моль/л. На основе расчетов докажите возможность выпадения солей в осадок и их последовательность осаждения. ПР[CaSO4] = 2,4.10−5; ПР[PbSO4] = 1,3.10−8; ПР[SrSO4] = 7,6.10−7.
Решение: Me2+ + SO42− = MeSO4
1) ИП[CaSO4] = [Me2+].[ SO42−] = 1.10−3 . 1.10−3 =1.10−6 < ПР[CaSO4] = 2,4.10−5, осадок CaSO4 не образуется;
2) ИП[PbSO4] = [Me2+].[ SO42−] = 1.10−3 . 1.10−3 =1.10−6 > ПР[PbSO4] = 1,3.10−8, осадок PbSO4 образуется;
3) ИП[SrSO4] = [Me2+].[ SO42−] = 1.10−3 . 1.10−3 =1.10−6 > ПР[SrSO4] = 7,6.10−7, осадок SrSO4 образуется.
4) В первую очередь выпадает PbSO4, т.к. у неё ПР наименьшая.
Вопросы и задачи для самоподготовки
1. Какое равновесие называют гетерогенным?
2. Выведите выражение произведения растворимости (ПР) малорастворимой соли на примере AgCl. При каких условиях осадки выпадают, растворяются
и находятся в равновесии с насыщенным раствором? Сравните ионное произведение (ИП) с произведением растворимости (ПР).
3. Как влияет на растворимость вещества введение в его насыщенный раствор одноимённого иона? Ответ мотивируйте.
4. Выведите формулы для расчёта ПР по известной растворимости (s) для случаев: а) BaSO4; б) Mn(OH)2; в) Cr(OH)3; г) Mg3(PO4)2; д) KtnAnm.
5. Сколько (г) CaSO4 растворяется в 1 л воды, если ПР(CaSO4) = 6,1 . 10-5? Ответ: 1,062 г.
6. В 1 л воды растворяется 0,001215 г Са3(РО4)2. Вычислите ПР(Са3(РО4)2). Ответ: 1 . 10-25.
7. Какая из солей более растворима в воде и во сколько раз: хлорид или хромат серебра, если ПР(AgCl)= 1,1 . 10-10, ПР(Ag2CrO4) =1,6 . 10-12? V(p-pa) = V(H2O).
Ответ: хромат серебра, в 7,3 раза по молям, в 16 раз по массе.
8. Сколько (г) AgBr содержится в 10 л насыщенного раствора, если ПР(AgBr) = 4 . 10-13. Ответ: 1,19 . 10-3г.
9. Сколько (г) BaSO4 содержится в 100 л насыщенного раствора, если ПР(BaSO4) = 1 . 10-10. Ответ: 0,233 г.
10. Сколько (г) NaOH надо прибавить к 20 мл 5 . 10-5М раствора МgCl2, чтобы образовался осадок Mg(OH)2? ПР(Mg(OH)2) = 1,2 . 10-11. Изменением объема при добавлении щелочи и выпадении осадка пренебречь. Ответ: 3,92 . 10-4 г.
11. Сколько мл 2М раствора HCl необходимо прибавить к 20 мл 0,03М раствора Pb(NO3)2, чтобы образовался осадок PbCl2? ПР(PbCl2) = 2,4 . 10-4.
Ответ: 0,894 мл.
12. Образуется ли осадок CaSO4, если к 0,1М раствору CaCl2 добавить равный объём 0,1 М раствора H2SO4? ПР(CaSO4) = 6,1 . 10-5. Ответ: образуется.
13. При каком значении рН начнется образование осадка Mg(OH)2 из 0,02 М раствора MgSO4? ПР(Mg(OH)2) = 1,2 . 10-11. Ответ: 9,38.
14. ПР (СаС2О4) = 2,67 . 10-9. Чему равна растворимость оксалата кальция в г/л? Ответ: 6,61 . 10-3.
15. В 100 мл насыщенного раствора содержится 2,156 . 10-3 г соли Ag2CrO4. Вычислите ПР соли. Ответ: 1,1 . 10-12
16. При каком значении рН начнется выпадение осадка Fe(OH)2 из 0,1 М раствора FeCl2 при добавлении щелочи? ПР(Fe(OH)2) = 1 . 10-15.
Ответ: при рН = 7.
17. В растворе содержатся сульфат-, хромат- и оксалат-ионы с концентрацией 1.10−3 моль/л. В этот раствор по каплям внесли раствор хлорида стронция до концентрации этой соли до 1.10−3 моль/л. На основе расчетов докажите возможность выпадения солей в осадок и их последовательность осаждения. ПР[SrSO4] = 3,2.10−7; ПР[SrCrO4] = 3,6.10−5; ПР[SrC2O4] = 5,6.10−8.
18. Произведение растворимости. В растворе содержатся хлорид-, бромид- и йодид-ионы с концентрацией 1..10−6 моль/л. В этот раствор по каплям внесли раствор нитрата серебра до концентрации этой соли до 1.10−5 моль/л. На основе расчетов докажите возможность выпадения солей в осадок и их последовательность осаждения. ПР[AgCl] = 1,8.10−10; ПР[AgBr] = 5,7.10−13; ПР[AgI] = 8,3.10−17.
1.6. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
Теоретическое пояснение: различают идеальные и реальные растворы. В идеальных растворах компоненты смешиваются, как идеальные газы, без изменения объема и энтальпии. Свойства идеальных растворов (давление насыщенного пара, температуры кипения и замерзания, осмотическое давление), не зависящие от природы веществ и определяемые лишь концентрацией (количеством) вещества называются коллигативными. Знание этих свойств позволяет определять молекулярную массу, степень диссоциации растворенного вещества, осмотическую концентрацию раствора.
Осмотическое давление в растворе проявляется только тогда, когда раствор отделен от растворителя полупроницаемой мембраной. На основании опытных данных было установлено, что осмотическое давление раствора пропорцио-нально концентрации растворенного вещества (Х) и абсолютной температуре: Росм. = C(X) . R . T (закон Вант-Гоффа), где R – газовая постоянная (8,314 Дж/(моль . K).
Закон справедлив для разбавленных растворов неэлектролитов. В случае сильноразбавленных растворов С(Х)» в (Х). В концентрированных растворах неэлектролитов и водных растворах электролитов наблюдаются отклонения от закона. Для учёта межмолекулярных взаимодействий Вант-Гофф ввёл поправочный коэффициент, названный изотоническим коэффициентом (i): Росм.= i . C(X) . R . T. Для растворов неэлектролитов i = 1. Для водных растворов электролитов i > 1, максимальное его значение равно числу ионов в молекуле электролита: NaCl (k = 2), CaCl2 (k = 3), Na3PO4 (k = 4), Al2(SO4)3 (k = 5).
Давление насыщенного пара присуще каждой жидкости. Пар, находящий-ся в равновесии с жидкостью, называется насыщенным. При растворении в жид-кости нелетучего вещества давление пара раствора понижается по сравнению с чистым растворителем. Разность между давлениями называется понижением давления пара растворителя (D p = p 0 – p). Если это понижение отнести к р 0, то оно называется относительным понижением (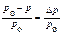 ), и оно равно молярной доле растворенного вещества (закон Рауля):
), и оно равно молярной доле растворенного вещества (закон Рауля):  или
или  ,
,
где n – число молей растворенного вещества, N - число молей растворителя.
В случае реальных растворов в это уравнение вводится изотонический коэффициент:  .
.
Температура кипения и кристаллизации растворов зависят от давления пара над растворами. Жидкость закипает тогда, когда давление её пара достигает внешнего атмосферного давления. Вследствие понижения давления пара растворителя над раствором температура кипения раствора всегда выше температуры кипения чистого растворителя. Разность между температурами кипения раствора и растворителя называется повышением температуры кипения (Dtкип. или DTкип.).
Жидкость кристаллизуется (затвердевает) тогда, когда давление её пара становится равным давлению насыщенного пара над соответствующей твёрдой фазой. Давление пара льда достигается у водного раствора при более низкой температуре, чем у растворителя (воды).
Разность между температурами кристаллизации растворителя и раствора называют понижением температуры кристаллизации (Dtкрист. или DTкрист.). Температуру кристаллизации иногда называют температурой замерзания.
Понижение температуры кристаллизации, повышение температуры кипения раствора пропорционально концентрации растворённого вещества (следствия из закона Рауля): Dtкрист.= K . в (X), Dtкип.= Е . в (X), где K и Е - коэффициенты пропорциональности, называемые криоскопической и эбулиоскопической постоянными, соответственно.
Если в (X) = 1 моль/кг, то K = Dtкрист., Е = Dtкип.. В этом заключён их физический смысл.
K и Е зависят от химической природы растворителя и не зависят от природы растворённого вещества.
Для реальных растворов: Dtкрист.= i . K . в (X), Dtкип.= i . Е . в (X).
С помощью закона Рауля и следствий из него можно вычислять молекулярные массы растворённых веществ:
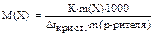 ,
, 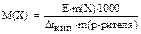
Метод криометрии (установления молярной массы по температурам замерзания растворов) используют и для определения осмотической концентра-ции биологических, агрономических и лекарственных средств (кровь, молоко, клеточный сок, растворы для инъекций, почвенные растворы). Она представляет собой суммарную концентрацию частиц (ионов, молекул) в растворе и выражается в условных единицах (моль/кг растворителя), т.к. молекулярные массы компонентов неизвестны.
Дата публикования: 2015-09-18; Прочитано: 3890 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
