 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,5 л 135 г глюкозы С6Н12О6 при 00С. Дано: V(p-pa) = 1,5 л m(С6Н12О6) = 135г
|
|
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,5 л 135 г глюкозы С6Н12О6 при 00С.
Дано:
V(p-pa) = 1,5 л
 m(С6Н12О6) = 135г
Pосм. =?
t = 00C, T = t0C + 273
M(С6Н12О6) = 180 г/моль m(С6Н12О6) = 135г
Pосм. =?
t = 00C, T = t0C + 273
M(С6Н12О6) = 180 г/моль
| Решение:
С(С6Н12О6) = 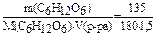 = 0,5 (моль/л);
Pосм. = C.R.T = 0,5.8,31.273 = 1134,315 (кПа)
Ответ: 1134,315 кПа. = 0,5 (моль/л);
Pосм. = C.R.T = 0,5.8,31.273 = 1134,315 (кПа)
Ответ: 1134,315 кПа. 
|
Пример 2. Определите молярную массу вещества, если в 5 л его раствора содержится 25г вещества. Осмотическое давление этого раствора равно 23 кПа при 200С.
Дано:
V(p-pa) = 5 л
P = 23 кПа
 t = 200C
M(X) =?
T = t0C + 273 t = 200C
M(X) =?
T = t0C + 273
| Решение:
1) С(Х) =  = 0,0945 (моль/л);
2) М(Х) = = 0,0945 (моль/л);
2) М(Х) = 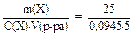 = 52,9 (г/моль)
Ответ: 52,9 г/моль. = 52,9 (г/моль)
Ответ: 52,9 г/моль.
|
Пример 3. Сколько (г) глюкозы С6Н12О6 должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего при той же температуре в 1 л 34,2 г сахарозы С12Н22О11?
Дано:
V(p-pa1) = 1 л
V(p-pa 2) = 1 л
m(С12Н22О11) = 34,2 г
 P1 = P2
m(С6Н12О6) =?
M1(С6Н12О6) = 180г/моль
M2(С12Н22О11)= 342 г/моль P1 = P2
m(С6Н12О6) =?
M1(С6Н12О6) = 180г/моль
M2(С12Н22О11)= 342 г/моль
| Решение:
1) по условию Р1 = P2,
следовательно С1 = С2
2) С2 =  = 0,1 (моль/л)
3) m1 = C1.M1.V1 = 0,1.180.1 = 18 (г).
Ответ: 18 г. = 0,1 (моль/л)
3) m1 = C1.M1.V1 = 0,1.180.1 = 18 (г).
Ответ: 18 г.
|
Пример 4. Какова степень электролитической диссоциации (a) дихлорук-сусной кислоты в 0,01 М растворе, если при 300 K этот раствор создает осмотическое давление 43596,4 Па?
Дано:
С(СHCl2COOH) =0,01моль/л
 Pосм. = 43596,4 Па
a =? Pосм. = 43596,4 Па
a =?
| Решение:
1) Росм. = i .C(X).R.T, 

|
2)  , где k - число ионов, на которые распадается молекула данного электролита: СHCl2COOH «СHCl2COO- + H+
, где k - число ионов, на которые распадается молекула данного электролита: СHCl2COOH «СHCl2COO- + H+
По уравнению k = 2,  . Ответ: 0,75 (75%).
. Ответ: 0,75 (75%).
Пример 5. Что произойдёт с эритроцитами при 310 K в 2%-ном растворе глюкозы (плотность раствора 0,006 г/мл)?
| Дано: T = 310 K w(C6H12O6) = 2% r = 1,006 г/мл Росм. =? M(C6H12O6) = 180 г/моль | Решение:
Росм. = C(X).R.T =  1) Росм. =
1) Росм. =  = 287,951 (кПа)
2) Росм.(р-ра глюкозы) < Росм.(крови), следовательно, в таком растворе произойдёт гемолиз. = 287,951 (кПа)
2) Росм.(р-ра глюкозы) < Росм.(крови), следовательно, в таком растворе произойдёт гемолиз.
|
Пример 6. Вычислите давление пара раствора, содержащего 34,2 г сахарозы С12Н22О11 в 180 г воды при 300С, если давление паров воды при этой температуре равно 0,42.105 Па.
| Дано: m(С12Н22О11) = 34,2 г m(H2O) = 180 г P0 = 4,2.104 Па P =? M(С12Н22О11) = 342 г/моль M(H2O) = 18 г/моль | Решение:
1) n = n(С12Н22О11) = 34,2/342 = 0,1 моль
2) N = n (H2O) = 180/18 = 10 моль
3) P = 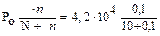 = 4,16.104 Па
Ответ: 4,16.104 Па. = 4,16.104 Па
Ответ: 4,16.104 Па.
|
Пример 7. Определите молярную массу вещества, если над раствором, содержащим 21 г вещества в 400 г ацетона, давление пара равно 21854,4 Па. Давление пара ацетона при этой температуре равно 23939,35 Па.
| Дано: m(в-ва) = 21 г m((СН3)2СО) = 400 г P1 = 21854,4 Па P0 = 23939,35 Па M(в-ва) =? M ((СН3)2СО) = 58 г/моль | Решение:
1) N = n((СН3)2СО) = 400/58 = 6,9 (моль)
2)  ; ; 
 ; n = 0,658; ; n = 0,658;
|
3) M(в-ва) = 21/ 0,658 = 32 (г/моль).
Ответ: 32 г/моль.
Пример 8. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола в 10 г бензола. Е(С6Н6) = 2,570, K(C6H6) = 5,10. Температура кипения чистого бензола равна 80,20С, а замерзания 5,40С.
| Дано: m(C6H5NO2) = 1г m(C6H6) = 10 г K(C6H6) = 5,10 Е(С6Н6) = 2,570 tкип. = 80,20C tзам. = 5,40C tкип. (p-pa) =? tзам. (p-pa) =? M(C6H5NO2) = 123 г/моль | Решение: 1) в (Х) = 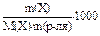 в (C6H5NO2) =
в (C6H5NO2) =  = 0,813 (моль/кг)
2) Dtзам.= K. в (X) .= 5,1.0,813 = 4,150,
Dtкип.= Е. в (X) .= 2,57.0,813 = 2,090;
3) tкип.= 80,2 + 2,09 = 82,290С
tзам.= 5,4 - 4,15 = 1,250С
Ответ: 82,290С; 1,250С. = 0,813 (моль/кг)
2) Dtзам.= K. в (X) .= 5,1.0,813 = 4,150,
Dtкип.= Е. в (X) .= 2,57.0,813 = 2,090;
3) tкип.= 80,2 + 2,09 = 82,290С
tзам.= 5,4 - 4,15 = 1,250С
Ответ: 82,290С; 1,250С.
|
Пример 9. Определите молярную массу вещества, если 4 г его растворены в 110 г этанола С2Н5ОН, и раствор кипит при 78,620С. Е(С2Н5ОН) = 1,220, температура кипения спирта 78,30С.
| Дано: m(в-ва) = 4 г m(C2H5OH) = 110 г E(C2H5OH) = 1,220 t = 78,30C M(в-ва) =? | Решение:
1) Dtкип.= 78,62 - 78,3 = 0,320
2) Dtкип.= Е. в (X) = 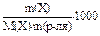 M(в-ва) =
M(в-ва) = 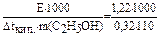 = 138,64
(г/моль). = 138,64
(г/моль).
|
Ответ: 138,64 г/моль.
Вопросы и задачи для самоподготовки.
1. Какие физико-химические свойства называют коллигативными? Перечислите.
2. От чего зависит количественное выражение этих свойств?
3. Какие мембраны называются полупроницаемыми? Приведите примеры материалов, обладающих свойством избирательной проницаемости.
4. Какое давление называют осмотическим? В каких приборах оно оп-ределяется?
5. От каких факторов зависит осмотическое давление и каким уравнением эта зависимость выражается?
6. В каких случаях растворы электролитов при одной и той же температуре имеют одинаковое осмотическое давление? Как называют такие растворы?
7. Какой раствор по отношению к другому называют: а) гипертоническим; б) гипотоническим? В сторону какого из них должен быть направлен осмос?
8. Дайте формулировку и приведите математическое выражение закона Рауля.
9. Какие два следствия вытекают из закона Рауля?
10. Когда жидкости затвердевают (кристаллизуются), закипают?
11. Какие константы называют криоскопической, эбулиоскопической конс-тантой? Зависят ли они от природы растворённого вещества и растворителя?
12. Верно ли утверждение, что все одномоляльные водные растворы неэлектролитов: а) закипают при 100,520С, б) кристаллизуются при -1,860С? Ответ мотивируйте.
13. Что называют изотоническим коэффициентом (i)? Каков его физический смысл? Каковы методы экспериментального определения?
14. Как связаны между собой степень электролитической диссоциации (ионизации) и изотонический коэффициент?
15. Как определяют молекулярные массы растворённых веществ по колли-гативным свойствам? Приведите формулы для расчёта.
16. Вычислите осмотическое давление раствора, в 1 л которого содержится 0,2 моля неэлектролита: а) при 00С; б) при 180С. Ответ: 4,54 . 105 Па; 4,84 . 105 Па.
17. Определите осмотическое давление раствора, в 1 л которого содержится 18,4 г глицерина (С3Н8О3) при 00С. Ответ: 454 кПа.
18. Вычислите осмотическое давление раствора, в 5 л которого содержится 171 г сахарозы С12Н22О11 при 250С. Ответ: 247,6 кПа.
19. 400 мл раствора содержит 2 г растворённого вещества при 270С. Осмотическое давление раствора 1,216 . 105 Па. Определите молярную массу растворённого вещества. Ответ: 102,5 г/моль.
20. Раствор сахарозы С12Н22О11 при 00С оказывает осмотическое давление 7,1 . 105Па. Сколько (г) сахарозы содержится в 250 мл такого раствора?
Ответ: 26,76 г.
21. Сколько (г) этанола С2Н5ОН надо растворить в 500 мл воды, чтобы осмотическое давление этого раствора при 200С составляло 4,052 . 105 Па. V(p-pa) = V(H2O). Ответ: 3,83 г.
22. Осмотическое давление раствора при 270С равно 1,32 . 105Па. Какова молярная концентрация этого раствора? Ответ: 0,053 моль/л.
23. Осмотическое давление раствора при 100С равно 1,2 . 105 Па. Какова моляр-ность этого раствора? Ответ: 0,05 моль/л.
24. Сколько (г) этанола С2Н5ОН должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего в 1 л при той же температуре 4,5 г формальдегида СН2О? Ответ: 6,9 г.
25. Определите молярную массу растворённого вещества, если раствор, содержащий в 0,5 л 6 г вещества, при 170С обладает осмотическим давлением 4,82 . 105 Па. Ответ: 60 г/моль.
26. Определите, будут ли при одной и той же температуре изотоническими 3%-ные водные растворы сахарозы С12Н22О11 и глицерина С3Н8О3. Плотности растворов примите равными 1 г/мл. Ответ подтвердите расчетами.
Ответ: не будут.
27. Рассчитайте осмотическое давление при 310 K 20%-ного водного раствора глюкозы (r = 1,08 г/мл), применяемого для внутривенного введения при отёке лёгкого. Каким будет этот раствор по отношению к крови, если учесть, что Росм. крови равно 740 - 780 кПа? Ответ: 3091,3 кПа; гипертоническим.
28. Рассчитайте осмотическое давление 0,01 М раствора хлорида калия при 310K, если изотонический коэффициент равен 1,96. Каким будет этот раствор по отношению к плазме крови (Росм. крови равно 740 - 780 кПа)?
Ответ: 50,5 кПа; гипотоничен.
29. Осмотическое давление раствора гемоглобина в воде, содержащего 124 г/л при 17оС равно 0,04338 атм. Рассчитайте молекулярную массу гемоглобина. Ответ: 67814 г/моль.
30. Рассчитайте осмотическое давление при 0оС в мм вод.ст. и понижение температуры кристаллизации 1%-ного альбумина (молекулярная масса 68000). Ответ: 34,1 мм вод.ст; 0,00028.
31. Вычислите давление пара 30%-ного водного раствора карбамида СО(NН2)2 при 500С. Давление пара воды при этой температуре равно 12,33 кПа.
Ответ: 10,93 кПа.
32. Определите давление пара раствора, содержащего 1,212 . 1023 молекул
вещества в 500 г воды при 1000С, если давление пара воды при этой температуре равно 101,3 кПа. Ответ: 100,58 кПа.
33. Давление пара раствора, содержащего 20 г растворённого вещества в 180 г воды равно 3,64 кПа. Определите молярную массу растворённого вещества, если давление пара воды при этой температуре равно 3,78 кПа.
Ответ: 52 г/моль.
34. Понижение давления пара над раствором, содержащим 5,4 г вещества в 180 г воды, при 800С и над чистым растворителем при той же температуре равно 144 Па. Определите молярную массу растворённого вещества.
Ответ: 180 г/моль.
35. Давление пара воды при 300С составляет 4245,2 Па. Сколько (г) сахарозы С12Н22О11 следует растворить в 800 г воды, для получения раствора, давление пара которого на 33,3 Па меньше давления пара воды? Вычислите процентную концентрацию сахарозы в растворе. Ответ: 119,8 г; 13%.
36. Давление пара воды при 500С равно 12334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды.
Ответ: 12140 Па.
37. Давление пара водного раствора неэлектролита при 800С равно 33310 Па. Сколько (моль) воды приходится на 1 моль растворённого вещества в этом растворе? Давление пара воды при этой температуре равно 47375 Па.
Ответ: 2,4 моль.
38. Рассчитайте молярную массу неэлектролита, если при 200С давление пара над 63%-ным водным раствором этого неэлектролита равно 1399,4 Па. Дав-ление паров воды при этой температуре равно 2335,42 Па. Ответ: 47 г/моль.
39. При какой температуре кипит раствор, содержащий 90 г глюкозы С6Н12О6 в 1000 г воды? Е(H2O) = 0,52. Ответ: 100,260С.
40. В какой массе воды следует растворить 46 г глицерина С3Н8О3, чтобы по-лучить раствор с температурой кипения 100,1040С. Е(H2O) = 0,52.
Ответ: 2,5 кг.
41. Вычислите массовую долю (в %) глицерина С3Н8О3 в водном растворе, температура кипения которого 100,390С. Е(H2O) = 0,52. Ответ: 6,45%.
42. Определите массовую долю (в %) сахарозы С12Н22О11 в водном растворе, если раствор закипает при 101,040С. Е(H2O) = 0,52. Ответ: 40,62%.
43. Раствор, содержащий 27 г вещества в 1000 г воды, кипит при 100,0780С. Определите молярную массу растворённого вещества. Е(H2O) = 0,52.
Ответ: 180 г/моль.
44. Раствор, содержащий 0,162 г серы в 20 г бензола С6Н6, кипит при темпе-ратуре на 0,0810 выше, чем чистый бензол. Рассчитайте молярную массу серы. Сколько атомов содержится в одной молекуле серы? Е(С6Н6) = 0,52.
Ответ: 256 г/моль; 8 атомов.
45. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира температура кипения повысилась на 0,453 K. Определите молекулярную массу растворенного вещества. Е(эфира) = 2,02. Ответ: 145 г/моль.
46. Водный раствор сахарозы С12Н22О11 замерзает при -1,10С. Определите массовую долю (в %) сахарозы в растворе. K(H2O) = 1,86. Ответ: 16,8%.
47. Вычислите массу воды, в которой следует растворить 300 г глицерина С3Н8О3, для получения раствора, замерзающего при -20С. K(H2O) = 1,86. Ответ: 3 кг.
48. Вычислите температуру замерзания 20%-ного раствора глицерина С3Н8О3 в воде. K(H2O) = 1,86. Ответ: -5,05С.
49. При какой температуре замерзает 4%-ный раствор этанола С2Н5ОН в воде? K(H2O) = 1,86. Ответ: -1,70С.
50. В 100 г воды растворили 4 г вещества. Полученный раствор замерзает при -0,930С. Определите молярную массу растворённого вещества. K(H2O) = 1,86. Ответ: 80 г/моль.
51. Раствор, содержащий 2,175 г растворённого вещества в 56,25 г воды, замерзает при -1,20С. Определите молярную массу растворённого вещества. K(H2O) = 1,86. Ответ: 60 г/моль.
52. 1,6 г вещества растворены в 250 г воды. Полученный раствор замерзает при -0,20С. Определите молярную массу растворённого вещества. K(H2O) = 1,86. Ответ: 59,52 г/моль.
53. Какой из растворов будет замерзать при более низкой температуре: 10%-ный раствор глюкозы С6Н12О6 или 10%-ный раствор сахарозы С12Н22О11? Ответ подтвердите расчетами. Ответ: глюкозы.
54. Определите формулу вещества, содержащего 39,34% углерода, 8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,3180 ниже, чем чистый бензол. K(С6Н6) = 0,52. Ответ: C4H10S2.
55. Определите понижение температуры замерзания крови, если осмотическое давление при 37оС равно 7,63 атм. Ответ: 0,56.
Дата публикования: 2015-09-18; Прочитано: 26976 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
