 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Различают прямую и косвенную потенциометрию или потенциометрическое титрование
|
|
Прямая потенциометрия (ионометрия) – это потенциометрический метод, в котором индикаторным электродом является ионоселективный электрод. Ионометрия – удобный, простой, экспрессный современный метод анализа. Для его реализации достаточно подобрать соответствующий ионоселективный электрод для определяемого иона. Особенно широко ионометрия используется при определении точной концентрации ионов Н+ в растворе. В качестве индикаторного электрода, как правило, применяют стеклянный электрод, селективный по отношению к ионам Н+. Измерения э.д.с. производят с помощью специальных приборов, называемых рН-метрами. Их шкала откалибрована таким образом, что вместо измеряемой э.д.с. показывает значение рН раствора.
Потенциометрическое титрование является разновидностью титриметрических методов анализа. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя точку эквивалентности на основании характера изменения э.д.с. измеряемой цепи в зависимости от объема добавляемого раствора. По полученным данным строят кривую потенциометрического титрования и на этой кривой определяют точку эквивалентности и объем израсходованного титранта в точке эквивалентности.
Потенциометрическое титрование может быть использовано для определения концентрации кислоты или основания в анализируемом растворе. В этом случае составляют гальваническую цепь, содержащую индикаторный стеклянный электрод и электрод сравнения с постоянным известным потенциалом (например, хлорсеребряный):
Ag ½ AgCl, HCl ½ «смб» ½ Н3О+ ½½ KCl, AgCl ½ Ag
a ax
индикаторный хлорсеребряный
стеклянный электрод электрод сравнения
где «смб» – стеклянная мембрана; а – известная активность ионов Н+ внутреннего раствора стеклянного электрода; ах – неизвестная активность ионов Н+ измеряемого раствора.
Э.д.с. такой гальванической цепи будет зависеть от концентрации ионов Н+ в исследуемом растворе. Измеряя её с помощью соответствующего прибора, можно непосредственно определить рН среды.
Титруемый раствор строго определенного объема помещают в электролитическую ячейку с электродами и при перемешивании из бюретки небольшими порциями добавляют титрант (например, раствор щелочи при определении концентрации кислоты в исследуемой системе). После каждого добавления очередной порции раствора щелочи с помощью потенциометра определяют рН раствора и затем по полученным данным строят кривую титрования в координатах рН раствора – V (титранта) (рис. 97).
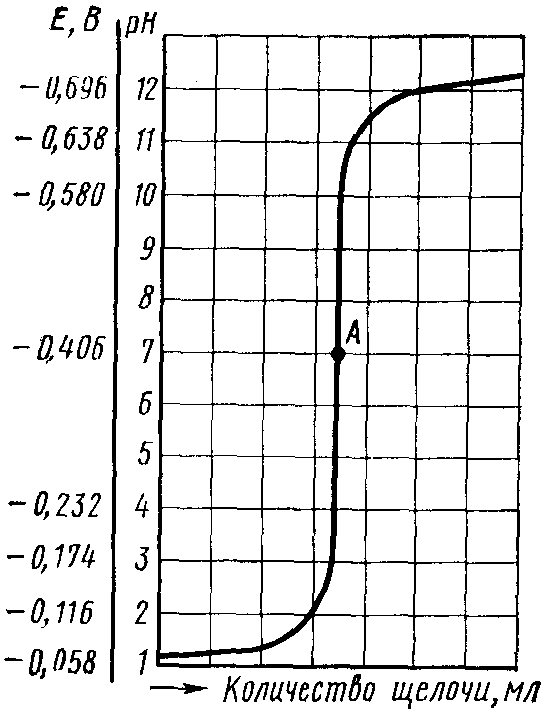
Рис. 97. Кривая потенциометрического титрования соляной кислоты гидроксидом натрия: А – точка эквивалентности
В случае титрования сильной кислоты щелочью точка эквивалентности будет лежать на середине скачка титрования (рН = 7).
В ряде случаев чувствительность потенциометрического метода превышает чувствительность обычного объемного метода, а также метода кондуктометрического титрования.
Содержание
Предисловие. 3
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА, КАК ТЕОРЕТИЧЕСКАЯ ОСНОВА БИОЭНЕРГЕТИКИ 5
Предмет, методы и основные понятия химической термодинамики.. 6
Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные. 8
Термодинамические параметры.. 11
Внутренняя энергия системы.. 14
Форма обмена энергии с окружающей средой. 16
Первое начало термодинамики. Тепловые эффекты химических
реакций.. 20
Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций 21
Термохимия. Закон Гесса. 24
Влияние температуры и давления на тепловой эффект реакции. 31
Использование закона Гесса в биохимических исследованиях. 32
Энтропия. Второй закон термодинамики.. 35
Энтропия. 35
Второе начало термодинамики. Свободная энергия Гиббса. 43
Принцип энергетического сопряжения. 49
Химическое равновесие. 51
Обратимые и необратимые реакции. Константа равновесия. 51
Смещение химического равновесия. Принцип Ле-Шателье. 58
УЧЕНИЕ О РАСТВОРАХ.. 63
Растворы... 64
Физические свойства Н2О и строение ее молекул. 66
Механизм образования растворов. 68
Растворимость веществ. Факторы, влияющие на растворимость. 73
Влияние природы веществ на растворимость. 74
Влияние давления на растворимость веществ. 75
Влияние температуры на растворимость веществ. 77
Влияние электролитов на растворимость веществ. 78
Взаимная растворимость жидкостей. 79
Способы выражения состава растворов. 82
Термодинамические аспекты процесса растворения.
Идеальные растворы.. 85
Коллигативные свойства разбавленных растворов.. 87
Диффузия и осмос в растворах. 87
Роль осмоса в биологических процессах. 93
Давление насыщенного пара растворителя над раствором.
Закон Рауля. 98
Следствия из закона Рауля. 101
Применение методов криоскопии и эбуллиоскопии. 105
Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа. 107
Электролитическая диссоциация. 110
Электролиты и неэлектролиты. Теория электролитической диссоциации. 110
Общая характеристика электролитов. 113
Слабые электролиты.. 114
Сильные электролиты.. 120
Диссоциация воды. Водородный показатель. 125
Теория кислот и оснований. Буферные растворы... 130
Теория кислот и оснований. 130
Буферные растворы.. 141
Определение буферных систем и их классификация. 141
Механизм действия буферных систем.. 145
Вычисление рН и рОН буферных систем. Уравнение Гендерсона-Гассельбаха 147
Буферная емкость. 152
Буферные системы человеческого организма. 155
Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз. 159
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ.. 161
Кинетика химических реакций.. 162
Понятие о скорости химической реакции. Закон действующих масс. 163
Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции. 169
Порядок и молекулярность простых химических реакций. 169
Понятие о сложных химических реакциях. 171
Классификация сложных реакций. 173
Измерение скорости химической реакции. 180
Влияние температуры на скорость химической реакции. 185
Катализ. 194
Общие положения и закономерности катализа. 194
Механизм гомогенного и гетерогенного катализа. 199
Особенности каталитической активности ферментов. 201
ФИЗИЧЕСКАЯ ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ.. 203
Определение дисперсных систем.. 204
Классификация дисперсных систем и их общая характеристика. 210
Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды.. 214
Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы.. 216
Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой 217
Методы получения дисперсных систем.. 218
Диспергирование жидкостей. 220
Диспергирование газов. 220
Конденсационные методы.. 221
Методы физической конденсации. 222
Методы химической конденсации. 223
Очистка золей. 224
Компенсационный диализ и вивидиализ. 227
Молекулярно-кинетические свойства золей.. 229
Броуновское движение. 229
Диффузия. 232
Седиментация в золях. 233
Осмотическое давление в золях. 234
Оптические свойства золей. 235
Рассеяние света (опалесценция) 236
Оптические методы исследования коллоидных систем.. 238
Механизм образования и строение коллоидной частицы – мицеллы... 240
Электрокинетические свойства золей.. 249
Устойчивость гидрофобных коллоидных систем. Коагуляция золей.. 256
Виды устойчивости золей. 256
Теория коагуляции Дерягина-Ландау-Фервея-Овербека. 259
Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди 262
Чередование зон коагуляции. 265
Коагуляции золей смесями электролитов. 266
Скорость коагуляции. 267
Коллоидная защита. 268
Роль процессов коагуляции в промышленности, медицине, биологии. 270
Растворы высокомолекулярных соединений.. 273
Общая характеристика высокомолекулярных соединений. 275
Классификация полимеров. 277
Набухание и растворение ВМС.. 281
Термодинамические аспекты процесса набухания. 286
Давление набухания. 287
Свойства растворов высокомолекулярных соединений. 288
Осмотическое давление растворов ВМС.. 289
Онкотическое давление крови. 290
Вязкость растворов полимеров. 291
Свободная и связанная вода в растворах. 294
Полиэлектролиты.. 295
Факторы, влияющие на устойчивость растворов полимеров.
Высаливание. 299
ЭЛЕКТРОХИМИЯ.. 301
Растворы электролитов как проводники второго рода. Электропроводность растворов электролитов.. 302
Эквивалентная электропроводность растворов. 307
Практическое применение электропроводности. 310
Равновесные электродные процессы... 313
Металлический электрод. 313
Измерение электродных потенциалов. 319
Окислительно-восстановительные электроды.. 322
Диффузионный и мембранный потенциалы.. 327
Химические источники электрического тока. Гальванические
элементы... 332
Потенциометрия. 338
Учебное издание
Болтромеюк Виктор Васильевич
ОБЩАЯ ХИМИЯ
Пособие для студентов лечебного, педиатрического,
медико-психологического и медико-диагностического
факультетов
Ответственный за выпуск В.А.Снежицкий
Компьютерная верстка А.В.Яроцкая
Корректор Л.С.Засельская
Подписано в печать 26.11.2009. Формат 60х84/16.
Гарнитура Таймс. Ризография.
Усл. печ. л. 20,0. Уч.-изд. л. 12,4. Тираж 99 экз. Заказ 165 п.
Издатель и полиграфическое исполнение
учреждение образования
«Гродненский государственный медицинский университет».
ЛИ № 02330/0548511 от 16.06.2009. Ул. Горького, 80, 230009, г. Гродно.
[1] В химической практике нелетучим обычно считают вещество, температура кипения которого не менее чем на 150оС выше температуры кипения растворителя.
Дата публикования: 2014-11-03; Прочитано: 2778 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
