 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примерами электродов второго рода могут служить хлорсеребряный и каломельный
|
|
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой малорастворимой в воде солью AgCl и погруженной в раствор хлорида калия (рис. 87).
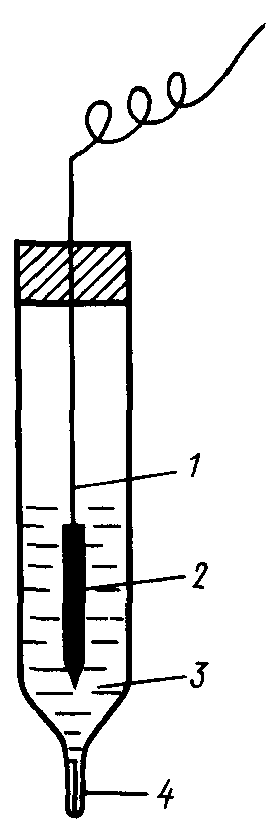
Рис. 87. Хлорсеребряный электрод:
1 – серебряная проволока; 2 – слой AgС1;
3 – раствор КС1; 4 – микрощель для контакта с внешним раствором
Ионы Ag+ образуются в растворе при частичном растворении соли AgCl
AgCl «Ag+ + Cl–
Концентрация их будет определяться не только растворимостью хлорида серебра, но и содержанием хлорида калия, который при диссоциации тоже образует ионы Cl– и смещает равновесие вышеприведенной реакции в сторону осаждения из раствора AgCl. Это, в свою очередь, приведет к уменьшению концентрации ионов Ag+ в растворе.
Каломельный электрод состоит из металлической ртути, покрытой пастой плохо растворимого хлорида ртути(I) Hg2Cl2 (иначе каломели), контактирующей с водным раствором KCl (рис. 88).
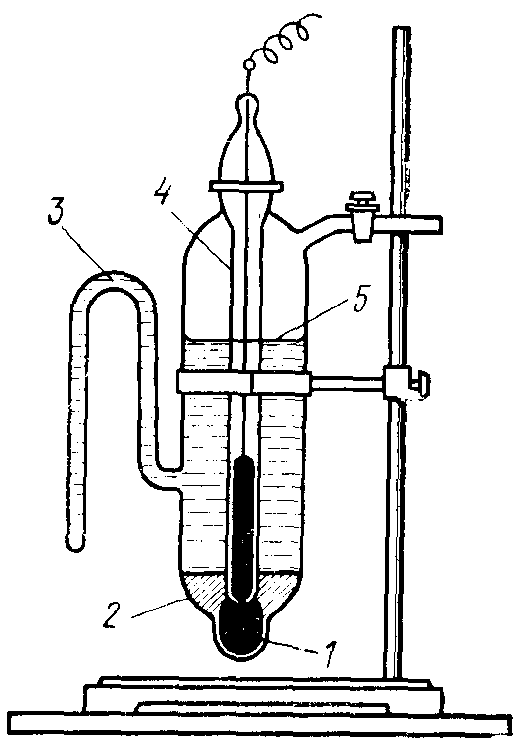
Рис. 88. Каломельный электрод: 1 – ртуть; 2 – паста из каломели;
3 – отросток для соединения каломельного электрода с другими электродами; 4 – платиновая проволока; 5 – раствор хлорида калия
Каломель, растворяясь в Н2О, диссоциирует с образованием ионов Нg22+ и Cl–:
Нg2Cl2 «Нg22+ + 2Cl–
В присутствии хлорида калия, содержащего одноименный с каломелью ион Cl–, растворимость Нg2Cl2 и концентрация ионов Нg22+ будет уменьшаться в зависимости от количества в растворе добавленной соли KCl и входящих в её состав ионов Cl–.
Потенциал хлорсеребряного и каломельного электродов рассчитывают по уравнению
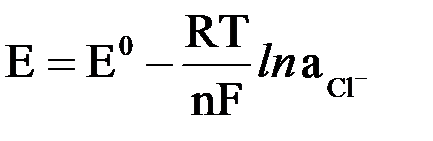
где 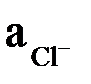 – активность ионов Cl–, образующихся при растворении KCl.
– активность ионов Cl–, образующихся при растворении KCl.
Это связано с тем, что легче измерить в растворе активность ионов Cl–, чем активность катионов Ag+ или Нg22+, образующихся при растворении плохо растворимой соли.
Дата публикования: 2014-11-03; Прочитано: 2310 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
