 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические источники электрического тока. Гальванические элементы
|
|
Химические источники электрического тока или гальванические элементы преобразуют энергию, выделяющуюся при протекании окислительно-восстановительных реакций, в электрическую энергию. Гальванические элементы служат источниками постоянного тока. Они подразделяются на химические и концентрационные.
Простейший химический гальванический элемент можно составить из двух металлических электродов, имеющих различные электродные потенциалы, и соединенных в замкнутую цепь.
На электроде, который имеет меньшее значение электродного потенциала, будет происходить процесс окисления. Такой электрод называется иначе анодом.
На электроде, который имеет большее значение электродного потенциала, будет происходить процесс восстановления. Такой электрод называется иначе катодом.
Рассмотрим более подробно принцип работы гальванических элементов на примере элемента, составленного из цинкового и медного электродов. Такой элемент называется иначе элементом Якоби-Даниэля (рис. 94).
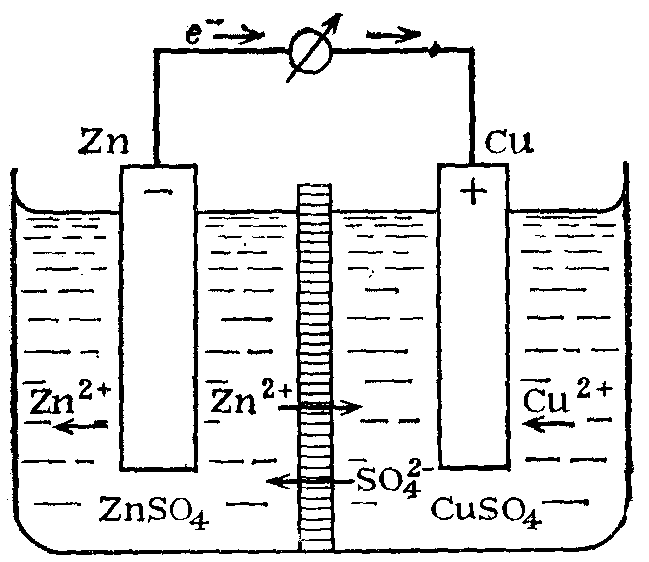
Рис. 94. Схема медно-цинкового гальванического элемента
Каждый электрод состоит из металлической пластинки, опущенной в раствор соли: ZnSO4 и CuSO4, соответственно.
Растворы солей отделены друг от друга пористой перегородкой, сквозь которую легко могут проходить ионы металлов и SO42-. Часто вместо пористой перегородки используют «солевой мостик» – стеклянную изогнутую трубку, заполненную насыщенным раствором KCl (рис. 95). В этом случае электроды не контактируют друг с другом, каждый из них находится в отдельном сосуде, которые соединяются с помощью солевого мостика.

Рис. 95. Схема медно-цинкового элемента с солевым мостиком: 1 – цинковая пластинка; 2 – медная пластинка; 3 – солевой мостик
При этом на цинковом электроде происходит процесс окисления:
Zn0 – 2ē = Zn2+,
в результате которого ионы цинка с пластинки переходят в раствор. Избыточные электроны по металлическому проводнику с цинковой пластинки переходят на медную и восстанавливают содержащиеся в растворе ионы Cu2+
Cu2+ + 2ē = Cu0,
которые в виде нейтральных атомов оседают на пластинке. Остающиеся свободные сульфат-ионы медного электрода и появившиеся в избытке ионы Zn2+ цинкового электрода через пористую перегородку или солевой мостик перемещаются навстречу друг другу. Таким образом, в цепи осуществляется перенос электрических зарядов и возникает электрический ток.
В этом элементе электрическая энергия получается в результате протекания химической реакции
Zn + CuSO4 = Cu + ZnSO4
Основной характеристикой гальванического элемента является электродвижущая сила (э.д.с.), от которой зависит сила тока в цепи. Она равна разности электродных потенциалов
э.д.с. = Е2 – Е1
где Е1 и Е2 – соответственно, потенциал анода и катода.
Для гальванического элемента Якоби-Даниэля электродвижущая сила равна
э.д.с. = ЕCu – EZn
Чем выше значение э.д.с. элемента, тем больше сила тока в его цепи.
Согласно уравнению Нернста, потенциал медного и цинкового электродов рассчитывается по формулам:
ECu = ECu0 + 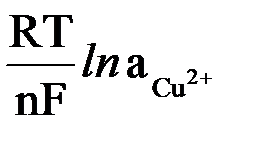
EZn = EZn0 + 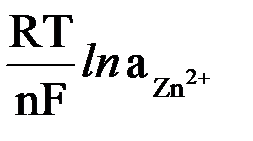
Вычитая второе уравнение из первого получим выражение для расчета э.д.с. медно-цинкового гальванического элемента
э.д.с. = ECu0 – EZn0 + 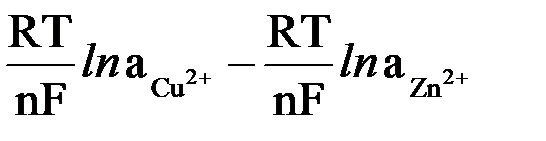 =
=
= ECu0 – EZn0 + 
Для любого другого элемента, составленного из двух металлических электродов, и в основе работы которого лежит химическая реакция, электродвижущая сила может быть вычислена по формуле:
э.д.с. = E20 – E10 + 
где Е20 и Е10 – стандартные электродные потенциалы, соответственно, катода и анода; n2 и n1 – величины зарядов ионов, участвующих в полуреакциях, которые протекают на катоде и аноде; а2 и а1 – активности ионов металла в растворах у катода и анода, соответственно).
Для температуры 298K, при подстановке значений констант R и F и при переходе от натурального логарифма к десятичному наше уравнение запишется иначе:
э.д.с. = E20 – E10 + 0,059 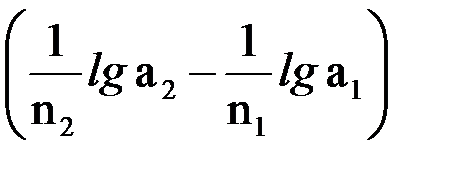
Гальванические элементы можно обозначать в виде схемы. Слева обычно приводится электрод или полуэлемент с меньшим значением электродного потенциала (анод), а справа – с большим значением электродного потенциала (катод).
При записи электродов сперва указывают твердую фазу (например, металл в случае металлического или редокс-электрода), а затем – вещества, растворенные в жидкой фазе. Фазы отделяются друг от друга одной вертикальной чертой. Если в одной фазе содержится несколько компонентов, то они записываются через запятую.
Границу раздела между растворами двух электродов изображают пунктирной вертикальной чертой или двумя сплошными линиями ½½ (если растворы отделяются друг от друга солевым мостиком).
В соответствии с вышеизложенными правилами, схема элемента Якоби-Даниэля выглядит следующим образом:
Zn ½ ZnSO4 ½½ CuSO4 ½ Cu
Гальванический элемент может быть составлен и из двух редокс-электродов, имеющих разное значение редокс-потенциала. Такие элементы называются иначе окислительно-восстановительными гальваническими элементами. Они тоже относятся к химическим гальваническим элементам, т.к. в основе их действия лежит протекание химической реакции.
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным. Он может состоять из двух одинаковых металлических электродов, погруженных в растворы одной и той же соли, но с различной концентрацией (активностью) ионов металла (рис. 96), например:
Zn ½ ZnSO4 ½½ ZnSO4 ½ Zn или Ag ½ AgNO3 ½½ AgNO3 ½ Ag
a1 a2 a1 a2
a1 < a2

Рис. 96. Цинковая концентрационная цепь: М – солевой мостик, содержащий хлорид калия
Электрод, находящийся в более разбавленном растворе, растворяется, его ионы переходят в раствор:
Zn – 2ē ® Zn2+
Ag – ē ® Ag+
Сам электрод при этом заряжается отрицательно.
На электроде, погруженном в более концентрированный раствор, наоборот, осаждаются ионы металла, и он заряжается положительно. Таким образом, на обоих электродах протекают процессы, приводящие к выравниванию концентрации ионов металла в растворах.
Потенциалы электродов при этом равны:
E1 = E0 + 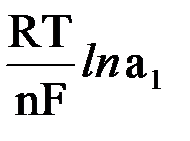 ; E2 = E0 +
; E2 = E0 + 
Вычитая первое уравнение из второго, получим формулу для подсчета э.д.с. с концентрационного элемента:
э.д.с. = E2 – E1 = 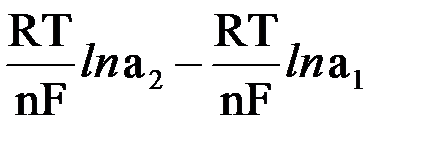
или
э.д.с. = 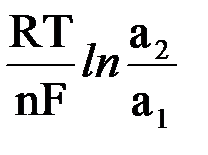
Концентрационный элемент будет работать до тех пор, пока активности ионов металлов в обоих растворах не сравняются; при а1 = а2 его э.д.с. будет равна 0.
Дата публикования: 2014-11-03; Прочитано: 5138 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
