 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Окислительно-восстановительные электроды
|
|
Существуют растворы, содержащие в своем составе два вещества, в которых атомы одного и того же элемента находятся в разной степени окисленности. Такие растворы называются иначе окислительно-восстановительными системами или редокс-системами (от латинского«reduction»– восстановление и «oxydation» – окисление).
Присутствующие в растворе молекулы или ионы, содержащие в своем составе атомы элемента с более высоким значением степени окисления, называются при этом окисленной формой, а те частицы, в состав которых входят атомы элемента с меньшей степенью окисления – восстановленной формой.
Редокс-системы часто записываются в виде дроби, причем окисленная форма помещается в числитель, а восстановленная – в знаменатель. Наиболее распространенными редокс-системами являются растворы двух солей, в которых атомы одного и того же металла имеют разную степень окисления, например:
1) раствор FeCl2 и FeCl3 (Fe3+ / Fe2+)
окисленная восстановленная
форма форма
2) раствор K4[Fe(CN)6] и K3[Fe(CN)6]([Fe3+(CN)6]3–/[Fe2+(CN)6]4–
окисленная восстановленная
форма форма
3) SnCl2 и SnCl4(Sn4+ / Sn2+)
окисленная восстановленная
форма форма
4) MnSO4 и KMnO4(Mn+7O4– / Mn2+)
окисленная восстановленная
форма форма
5) K2Cr2O7 и Cr2(SO4)3 (Cr2+6O72–/2Cr3+)
окисленная восстановленная
форма форма
В водном растворе обе эти формы могут обратимо превращаться друг в друга с установлением между ними динамического равновесия. Протекающие при этом процессы бывают двух видов.
1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
Fe3+ + ē «Fe2+
[Fe3+[(CN)6]]3– + ē «[Fe2+(CN)6]4–
Sn4+ + 2ē «Sn2+
2. Переход окисленной формы в восстановленную, кроме обмена электронами, сопровождается участием в этом процессе других частиц, чаще всего ионов Н+ и молекул Н2О:
Mn+7O4– + 8H+ + 5ē «Mn2+ + 4H2O
Cr2+6O72– + 14H+ + 6ē «2Cr3+ + 7H2O
Br+O– + H2O + 2ē «Br– + 2OH–
Если в водный раствор, содержащий окислительно-восстановительную систему, опустить пластинку из инертного по отношению к её компонентам электропроводящего материала: благородного металла (Au, Pt) или графита – на ней будет наблюдаться образование электрического заряда за счет обмена электронами:
Red 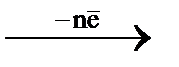 Pt
Pt 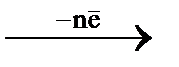 Ox
Ox
восстановленная окисленная
форма форма
При этом данная пластинка (например, платиновая) выступает в качестве посредника при обмене электронами между окисленной и восстановленной формами. Конечно, возможен обмен электронами между ионами и напрямую, но для его совершения требуются гораздо большие энергетические затраты, чем при переходе электронов от восстановленной формы на инертный металл и затем с поверхности металла на окисленную форму.
В случае избыточного содержания в растворе восстановленной формы (донора электронов) часть перешедших на пластинку электронов так и останутся невостребованными и задержатся на ней, сообщая пластинке отрицательный, относительно раствора, электрический заряд.
При избытке окисленной формы (акцептора электронов) в ходе установления состояния равновесия на её частицы перейдет и часть собственных электронов платины. В результате этого на пластинке образуется положительный, относительно раствора, электрический заряд.
Систему, состоящую из пластинки инертного металла, опущенной в раствор, содержащий окисленную и восстановленную формы одного и того же элемента, называют окислительно-восстановительным электродом (редокс-электродом), а возникающий на ней потенциал – окислительно-восстановительным потенциалом или редокс-потенциалом.
Характерной особенностью такого электрода является то, что металлическая пластинка не претерпевает в происходящих процессах никакого химического изменения и выполняет роль лишь передатчика электронов. Ионы или атомы металла пластинки в химическое взаимодействие с компонентами раствора не вступают. Их самопроизвольный переход с поверхности пластинки в раствор за счет действия молекул растворителя настолько мал, что им можно пренебречь.
Таким образом, величина редокс-потенциала будет зависеть от природы частиц, образующих редокс-систему (т.е. от того, насколько легко восстановленная форма отдает свои электроны и насколько прочно эти электроны удерживает окисленная форма), и от их концентрации в растворе.
Рассчитать величину редокс-потенциала можно с помощью уравнения Нернста-Петерса или просто уравнения Петерса (в честь немецкого физико-химика Р. Петерса, показавшего применимость уравнения Нернста не только к металлическим электродам, но и к окислительно-восстановительным системам):
E = E0 + 
где Е – редокс-потенциал, B; Е0 – стандартный или нормальный редокс-потенциал, возникающий в системе с одинаковой активностью (либо концентрацией для разбавленных растворов) окисленной (Ox) и восстановленной (Red) форм; n – число электронов, которые принимают одна молекула или ион окисленной формы, превращаясь в восстановленную форму.
Для окислительно-восстановительных систем Fe3+/Fe2+, MnO4–/Mn2+, Cr2O72–/2Cr3+, BrO–/Br– n равно, соответственно, 1, 5, 6 и 2.
Если в процессе перехода окисленной формы в восстановленную, кроме электронов, принимают участие и другие частицы, то их равновесные активности или концентрации тоже должны находиться под знаком логарифма в уравнении Петерса. Исключение составляют молекулы Н2О, т.к. в разбавленных растворах можно считать, что их концентрация при протекании химических реакций изменяется крайне незначительно.
Для окислительно-восстановительной системы MnO4–/Mn2+, в которой осуществляется следующий электродный процесс:
MnO4– + 8H+ + 5ē «Mn2+ + 4H2O
редокс-потенциал рассчитывается по формуле:
E = E0 + 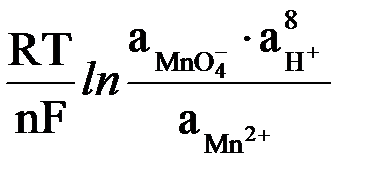
Соответственно, для редокс-системы с электродным процессом:
BrO– + H2O + 2ē «Br– + 2OH–
редокс-потенциал можно рассчитать по формуле:
E = E0 + 
Если измерения редокс-потенциалов осуществляются при температуре 298K (25оС), то при переходе от натурального логарифма к десятичному и подстановке значений постоянных величин R и T уравнение Петерса принимает вид:
E = E0 + 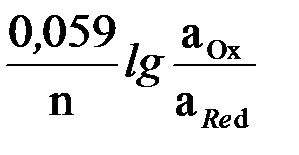
Значения Е0 для редокс-электродов определяют экспериментально относительно стандартного водородного электрода или какого-нибудь другого электрода сравнения (хлорсеребряного либо каломельного).
При этом активности окисленной и восстановленной форм редокс-системы должны быть одинаковыми, а активность других частиц, принимающих участие в реакции (Н+, ОН–) – равной 1 моль/дм3.
Экспериментально полученные величины Е0 редокс-электродов помещают в специальные справочники в виде таблиц, в которых обычно указывают состав редокс-системы и протекающую электродную реакцию (табл. 22).
Таблица 22. Стандартные редокс-потенциалы некоторых окислительно-восстановительных систем
| Редокс-система | Протекающая электродная реакция | Е0, В |
| Fe3+/Fe2+ | Fe3+ + ē «Fe2+ | 0,771 |
| Sn4+/Sn2+ | Sn4+ + 2ē «Sn2+ | 0,153 |
| [Fe3+(CN)6]3–/ [Fe2+(CN)6]4– | [Fe3+(CN)6]3– ē «[Fe2+(CN)6]4– | 0,36 |
| MnO4–/Mn2+, | MnO4– +8H+ + 5ē «Mn2+ + 4H2O | 1,51 |
| BrO–/Br– | BrO– + H2O 2ē «Br– + 2OH– | 0,76 |
| ClO3–/Cl– | ClO3– + 6 H+ + 6ē «Cl– + 3H2O | 1,45 |
| Cr2O72–/2Cr3+ | Cr2O72– + 14H+ + 6ē «2Cr3+ + 7H2O | 1,33 |
| MnO4–/MnO42– | MnO4– + ē «MnO42– | 0,56 |
| Cl2/2Cl– | Cl2 + 2ē «Cl– | 1,36 |
| HBrO/Br– | HBrO + H+ + 2ē «Br– + H2O | 1,34 |
| Cu2+/Cu+ | Cu2+ + ē «Cu+ | 0,16 |
Зная Е0 для редокс-системы, можно с помощью уравнения Нернста рассчитать величину редокс-потенциала в том случае, когда содержание окисленной и восстановленной форм в растворе не будут равны друг другу.
Величины Е0 для окислительно-восстановительных систем можно использовать для определения направления протекания окислительно-восстановительных реакций, т.к. они характеризуют относительную окислительную способность системы.
Система, редокс-потенциал которой имеет большее значение, выступает в роли окислителя по отношению к системе, редокс-потенциал которой имеет меньшее значение.
Дата публикования: 2014-11-03; Прочитано: 2100 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
