 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Измерение электродных потенциалов
|
|
Абсолютное значение электродного потенциала непосредственно определить нельзя. Можно измерить лишь разность потенциалов, возникающую между двумя электродами, образующими замкнутую электрическую цепь:
DЕ = Е2 – Е1
В связи с этим для практических целей применяют условную величину, характеризующую потенциал электрода относительно другого электрода, взятого за стандарт (электрод сравнения). При этом потенциал электрода сравнения принимают равным 0. Тогда потенциал определяемого электрода будет равен измеренной DЕ (если Е определяемого электрода > Е электрода сравнения) или –DЕ (если Е определяемого электрода < Е электрода сравнения).
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят равным нулю.
Водородный электрод (рис. 89) представляет собой специально обработанную платиновую пластинку, которая опущена в раствор кислоты (H2SO4 или HCl) с активностью ионов Н+ в нём, равной 1 моль/дм3. Через раствор с постоянной скоростью про-
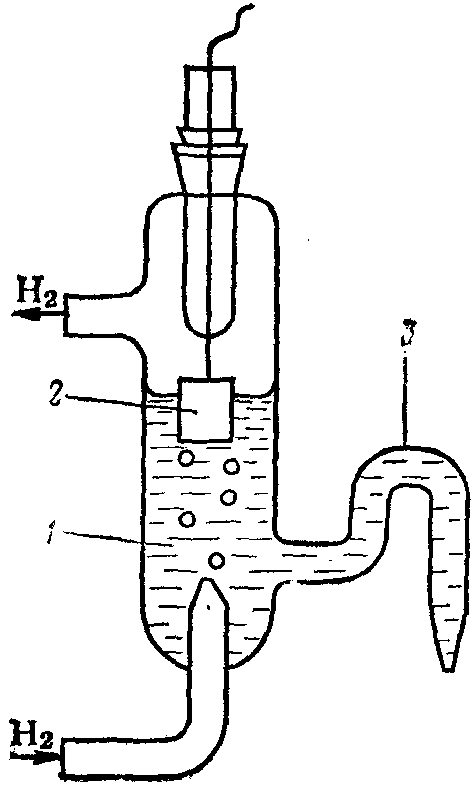
Рис. 89. Водородный электрод: 1 – раствор Н2SO4; 2 – платиновая пластинка с проводом; 3 – сифон для соединения с другим электродом
пускается газообразный Н2 под давлением 101,325 кПа. Молекулы Н2, адсорбируясь на поверхности платины, частично диссоциируют с образованием ионов Н+:
Н2 «2Н+ + 2ē,
которые могут обмениваться с аналогичными ионами, находящимися в растворе кислоты.
Таким образом, водородный электрод подобен металлическому электроду первого рода. Его потенциал будет зависеть от концентрации ионов Н+ в растворе кислоты.
Разность потенциалов между металлом, погруженным в раствор своей соли, с активностью ионов Men+ в нём, равной 1 моль/дм3, и стандартным водородным электродом, измеренная при 298 K, называется стандартным или нормальным электродным потенциалом металла (Е0).
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится электрохимический ряд напряжений металлов или ряд их активности (табл. 21).
Таблица 21. Электрохимический ряд напряжений металлов
| Электрод | Электродная реакция | Е0, В | Электрод | Электродная реакция | Е0, В |
| Li / Li+ | Li ↔ Li+ + ē | -3,045 | Cd / Cd2+ | Cd ↔ Cd2+ + 2ē | -0,403 |
| K / K+ | K ↔ K+ + ē | -2,924 | Co / Co2+ | Co ↔ Co2+ + 2ē | -0,277 |
| Ba / Ba2+ | Ba ↔ Ba2+ + 2ē | -2,900 | Ni / Ni2+ | Ni ↔ Ni2+ + 2ē | -0,250 |
| Ca / Ca2+ | Ca ↔ Ca2+ + 2ē | -2,866 | Sn / Sn2+ | Sn ↔ Sn2+ + 2ē | -0,136 |
| Na / Na+ | Na ↔ Na+ + ē | -2,714 | Pb / Pb2+ | Pb ↔ Pb2+ + 2ē | -0,126 |
| Mg / Mg2+ | Mg ↔ Mg2+ + 2ē | -2,363 | Fe / Fe3+ | Fe ↔ Fe3+ + 3ē | -0,037 |
| Al / Al3+ | Al ↔ Al3+ + 3ē | -1,663 | H2 / 2H+ | H2 ↔ 2H+ + 2ē | |
| Mn / Mn2+ | Mn ↔ Mn2+ + 2ē | -1,179 | Cu / Cu2+ | Cu ↔ Cu2+ + 2ē | 0,337 |
| Cr / Cr2+ | Cr ↔ Cr2+ + 2ē | -0,913 | Ag / Ag+ | Ag ↔ Ag+ + ē | 0,799 |
| Zn / Zn2+ | Zn ↔ Zn2+ + 2ē | -0,763 | Hg / Hg2+ | Hg ↔ Hg2+ + 2ē | 0,850 |
| Cr / Cr3+ | Cr ↔ Cr3+ + 3ē | -0,744 | Pt / Pt2+ | Pt ↔ Pt2+ + 2ē | 1,188 |
| Fe / Fe2+ | Fe ↔ Fe2+ + 2ē | -0,440 | Au / Au3+ | Au ↔ Au3+ + 3ē | 1,498 |
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего его катиона. Вертикальная черта изображает поверхность раздела двух фаз, где происходит скачок потенциала.
Дата публикования: 2014-11-03; Прочитано: 2575 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
