 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Значение нормального электродного потенциала количественно характеризует способность металла отдавать электроны, т.е. его восстановительные свойства
|
|
В электрохимическом ряду напряжений восстановительная активность металлов в водных растворах уменьшается с ростом их нормального электродного потенциала. Металлы, стоящие в начале ряда, легко отдают свои валентные электроды и превращаются в положительно заряженные ионы. Металлы, стоящие в конце ряда, делают это с трудом.
Зная стандартный электродный потенциал металла, можно рассчитать по уравнению Нернста его электродный потенциал при любой концентрации или активности ионов Men+ в растворе.
Следует отметить, что подготовка водородного электрода к работе сопряжена со значительными трудностями. Давление, под которым подаётся газообразный Н2 к платиновой пластинке, должно быть постоянным и равным 101,325 кПа. Кроме того, не должна изменяться и скорость подвода газа. Сам водород должен быть совершенно чистым, так как уже весьма малые количества примесей (особенно H2S и AsH3), «отравляют поверхность платины и тем самым препятствуют установлению равновесия
Н2 «2Н+ + 2ē
Получение Н2 высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике в качестве электродов сравнения часто используют каломельный или хлорсеребряный электроды. Они более компактные, обладают устойчивым потенциалом, мало зависящим от внешних условий.
Их стандартные электродные потенциалы определяют относительно водородного электрода.
При использовании насыщенного раствора KCl:
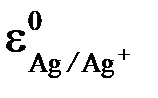 = 0,222 B (222 мV),
= 0,222 B (222 мV), 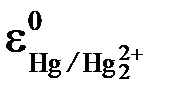 = 0,242 B (242 мV)
= 0,242 B (242 мV)
Особенно удобным является хлорсеребряный электрод, т.к. его составные части, в отличие от каломельного электрода, не являются токсичными и не требуют специальных мер предосторожности в работе.
Дата публикования: 2014-11-03; Прочитано: 768 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
