 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Металлический электрод
|
|
При опускании металлической пластинки в воду на её поверхности возникает отрицательный электрический заряд. Механизм его появления состоит в следующем. В узлах кристаллической решетки металлов находятся положительно заряженные ионы или нейтральные атомы, между которыми двигаются свободные электроны.
В водной среде катионы, расположенные на поверхности кристаллической решетки, гидратируются полярными молекулами воды и переходят в жидкую фазу, заряжая её положительно. Металл, в котором появился избыток электронов, приобретает отрицательный заряд (рис. 86).
Отрицательный заряд металлической пластинки препятствует дальнейшему переходу ионов металла в раствор и вызывает обратный процесс – переход его катионов из раствора на металл. При равенстве скоростей этих противоположно направленных процессов в системе устанавливается динамическое равновесие, в ходе которого пластинка и прилегающий к ней водный слой приобретают постоянный электрический заряд, одинаковый по величине, но противоположный по знаку. Величина этого заряда в данном случае будет зависеть от природы металла и от температуры жидкости.
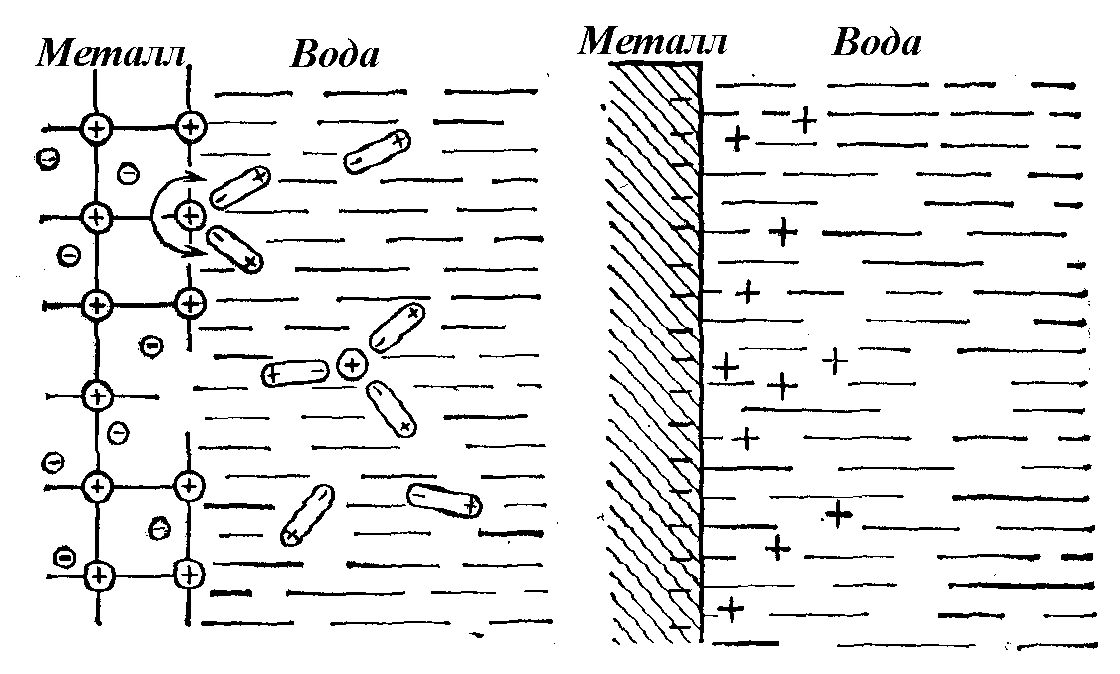
Рис. 86. Схема, объясняющая возникновение разности электрического потенциала на границе металл – вода
Схематически протекающие при этом процессы можно изобразить следующим образом:
Ме – nē «Меn+
Двойной электрический слой, возникающий на границе раздела между металлом и жидкостью, имеет не плоское, а диффузионное строение. Электростатическому притяжению катионов со стороны пластинки противодействуют силы взаимного отталкивания между ионами Меn+ и их тепловое движение. По мере удаления от поверхности металла концентрация его катионов в водном слое убывает.
Если металлическую пластинку опустить не в воду, а в раствор соли этого металла, то величина заряда, возникающего на пластинке при установлении равновесия, будет определяться ещё и концентрацией ионов металла в исходном растворе.
Это связано с тем, что в ионообменных процессах в данном случае смогут принимать участие и катионы добавленного электролита.
Активные металлы (магний, цинк, железо, кобальт и т.д.) и в воде, и в растворе собственной соли, как правило, заряжаются отрицательно. Пластинки малоактивных металлов (таких как медь, ртуть, серебро и т.д.) в растворе собственной соли, наоборот, заряжаются положительно, т.к. их катионы с поверхности кристаллической решетки могут переходить в раствор в незначительных количествах и поэтому до наступления равновесия преобладает обратный процесс – осаждение катионов из раствора на металл. В результате пластинка приобретает положительный заряд, а раствор, в котором остались анионы соли – отрицательный заряд.
Система, состоящая из металлической пластинки, опущенной в раствор собственной соли, называется металлическим электродом. Разность потенциалов, которая устанавливается между пластинкой и прилегающим к ней водным слоем, называется электродным потенциалом.
Его величина будет определяться не только прочностью связей в кристаллической решетке металла и температурой системы, но и активностью катионов металла соли в растворе. Эта зависимость выражается уравнением Нернста:
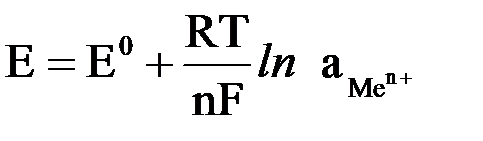
где Е – электродный потенциал, В; Е0 – стандартный электродный потенциал, т.е. потенциал, который возникает на электроде при активности ионов металла соли в растворе, равной 1 моль/дм3 и температуре 298 K (25оС); R – универсальная газовая постоянная, 8,314 Дж/(моль ∙ K); Т – температура, K; n - величина заряда иона металла; F – постоянная Фарадея, равная 96500 Кл/моль; 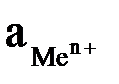 – активность ионов металла в растворе.
– активность ионов металла в растворе.
Для достаточно разбавленных растворов солей активность ионов металла можно заменить их молярной концентрацией.
В этом случае для температуры 298 K при переходе от натурального логарифма к десятичному и подстановке значений констант R и F уравнение Нернста принимает более простой вид:

где  – молярная концентрация ионов металла в растворе.
– молярная концентрация ионов металла в растворе.
Дата публикования: 2014-11-03; Прочитано: 2698 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
